
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ�� ����ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
���� ��1������̼������������������ƽ�ⳣ�����бȽ���������̼�ᡢ̼����������������Դ�С���Ӷ��ó���Ӧ���д����Ӧ�����ӷ���ʽ��
��2������ʵ��1��ʵ��2�¶ȱ仯�Ƚ�ƽ�ⳣ�����жϷ�Ӧ�ȣ�����Ũ���̺�ƽ�ⳣ���ȽϷ����жϣ�
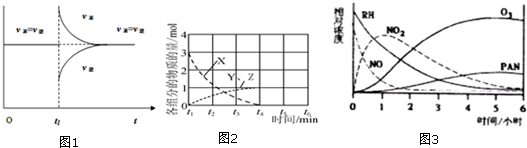
��3������ͼ1t1ʱ�̸ı�������v������˲������v���棩��С��v��������v���棩����ƽ��һ�������ƶ����ݴ˷�����
��4������һ�����������������仯Ϊ����������仯Ϊ������̼�����е���ת���غ���ʽ���㣻
��5��NO��40���·ֽ��������ֻ��������Ԫ���غ��֪���ɵ�ΪN���������ͼ���֪3molNO�������ֵ����������Ϊ1mol������ԭ���غ��жϲ��
��6��A����������������������Ũ�ȣ�
B������ͼ��仯�����ƣ�RH��NO��Ũ��һֱ�ڼ��٣�O3��PAN��Ũ��һֱ�����ӣ�NO2��Ũ�����������٣�
C����ijһʱ����ڵı仯������仯�IJ�ͬ����Ҳ�DZ�����״��㣬��NO��ʧ��������0-1ʱ����ڱ�PH�Ŀ죬��0-1ʱ�����NO��������NO2�ȣ�
D��O3��Ũ��һֱ�ڼ��ٲ������Ƿ�Ӧ�
��� �⣺��1������Ka2=5.61��10-11��Ka1=9.1��10-8��Ka1=4.30��10-7��Ka2=5.61��10-11��Ka2=1.1��10-12�������������ܹ���̼������Һ��Ӧ����̼�����ƺ����⻯�ƣ���Ӧ�����ӷ���ʽΪ��CO32-+H2S=HCO3-+HS-��
�ʴ�Ϊ��CO32-+H2S=HCO3-+HS-��
��2��ʵ��1����ƽ�ⳣ����
H2O��g��+CO��g��?CO2��g��+H2��g��
��ʼ 1mol/L 2mol/L 0 0
ת�� 0.8mol/L 0.8mol/l 0.2mol/l 0.2mol/l
ƽ�� 0.2mol/L 1.2mol/L 0.2mol/l 0.2mol/l
K=$\frac{0.8��0.8}{0.2��1.2}$=2.67��
ʵ��1�����¶�ʵ��2��ʵ��2����ƽ�ⳣ����
H2O��g��+CO��g��?CO2��g��+H2��g��
��ʼ 0.5mol/L 1mol/L 0 0
ת�� 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
ƽ�� 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{0.2��0.2}{0.3��0.8}$=0.167���¶�����K��С���¶�����ƽ�����淴Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ����H��0��
��1mol C0��3mol H20��2mol C02��5mol H2���ֱ���������
Qc=$\frac{\frac{2}{2}��\frac{5}{2}}{\frac{1}{2}��\frac{3}{2}}$=$\frac{10}{3}$��K
��Ӧ������У�v��������v���棩��
�ʴ�Ϊ����������
��3������ͼ1t1ʱ�̸ı�������v������˲������v���棩��С��v��������v���棩����ƽ��һ�������ƶ���
��ѡA��
��4���ռ�ij����β��������NOx�ĺ���Ϊ1.12%����������������ü��齫����ȫת��Ϊ�����壬����1��104L����״���£���β����Ҫ����30g����β����NO���ʵ���Ϊx��NO2���ʵ���Ϊy��2NO��N2��4e-��2NO2��N2��4e-��CH4��CO2��8e-��
2x+4y=$\frac{30g}{16g/mol}$��8=15mol
x+y=$\frac{1��1{0}^{4}L��1.12%}{22.4L/mol}$=5mol
����õ�x=2.5mol��y=2.5mol
���V��NO����V��NO2��=1��1
�ʴ�Ϊ��1��1��
��5��NO��40���·ֽ��������ֻ��������Ԫ���غ��֪���ɵ�ΪN���������Ԫ�ص���������NO��N2O��NO2��N2O3��N2O4��N2O5����ͼ���֪3molNO�������ֵ����������Ϊ1mol���䷴Ӧ����ʽΪ��3NO=Y+Z������ԭ���غ��֪ΪN2O��NO2��
�ʴ�Ϊ��N2O��NO2��
��6��A��������б�ʿ�֪��ijһʱ�����NO��ʧ�����ʱ�RH�죬��A��ȷ��
B��NO��Ũ��һֱ�ڼ��٣�NO2��Ũ�������Ӻ���٣���0-1ʱ�����NO��������NO2����B��ȷ��
C��ͼ��O3��PAN��Ũ�����ӣ�RH��Ũ�ȼ��٣�RH��NO2��ijһʱ����ڿ��ܷ�Ӧ����PAN��O3����C��ȷ
D��O3��Ũ��һֱ�����ӣ���������Ϊ��Ӧ���D����
��ѡD��
���� �����ۺϿ��黯ѧƽ��ͻ�ѧ��Ӧ���ʵ�֪ʶ������ʱע�����Ӱ��ƽ���ƶ��������Լ�ƽ�ⳣ�����йؼ��㣬��Ϊ��ѧƽ�ⳣ�������⣮


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=7����Һ��һ����������Һ | |
| B�� | 0.2 mol•L-1������������ˮ��Ϻ�pH=1������仯���Բ��ƣ� | |
| C�� | ���Է����еĻ�ѧ��Ӧ��һ���ǡ�H��0����S��0 | |
| D�� | NaNO2��������ˮ��ٽ�ˮ�ĵ��루��֪Ka��HNO2��=4.6��10-4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | NaN3��KN3�ṹ���ƣ�ǰ�߾����ܽ�С | |
| B�� | ��һ�����ܣ�I1����N��P��S | |
| C�� | �ƾ����ṹ�������Ľṹ���þ�����̯��2����ԭ�� | |
| D�� | ���������º��ȶ�������Ϊ���ĵ縺��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 2molSO2��1molO2 | 4molSO3 |
| ƽ��ʱn��SO3��/mol | 1 | m |
| ��Ӧ���ת���� | ��1 | ��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧ�� | C-H | C-F | H-F | F-F |
| ����/��kJ•mol-1�� | 414 | 489 | 565 | 155 |
| A�� | ����1940 kJ | B�� | ����1940 kJ | C�� | ����485 kJ | D�� | ����485 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| H2��g�� | Br2��g�� | HBr��g�� | |
| 1mol�����еĻ�ѧ������ʱ��Ҫ���յ�����/kJ | 436 | 200 | 369 |
| A�� | ��H=+102kJ/mol | B�� | ��H=-102kJ/mol | C�� | ��H=+267kJ/mol | D�� | ��H=-267kJ/mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com