
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
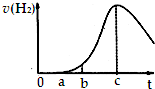 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 危险性 | 危险品 |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质,设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
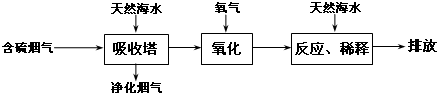
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | 溶液BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| A | NaHCO3溶液 | Na2CO3 | Ba(OH)2溶液 |
| B | Fe2O3 | Al2O3 | NaOH溶液 |
| C | FeCl3溶液 | CuCl2 | Fe |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液 | 加入的物质 | 答案序号 |
| AlCl3溶液 | 通入过量的NH3 | ① |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ② |
| NaAlO2溶液 | 滴加稀H2SO4至过量 | ③ |
| MgCl2和AlCl3的混合液 | 滴加NaOH溶液至过量 | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电解质溶液 | 阳极 | 阴极 | 加入的物质 | |
| A | NaCl溶液 | 碳 | 铁 | 盐酸 |
| B | 稀硫酸 | 铜 | 碳 | 水 |
| C | 硫酸铜溶液 | 铜 | 碳 | 硫酸铜 |
| D | NaOH溶液 | 碳 | 铁 | 水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com