
 已知各种金属离子完全沉淀的pH如下表:
已知各种金属离子完全沉淀的pH如下表:| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
分析 (1)结合与ZnS的反应可知,MnO2在酸性溶液与CuS反应生成硫酸铜、硫酸锰、S与水,MnO2在酸性溶液与FeS发生硫酸铁、硫酸锰、S与水;
(2)由滤液A中加入Zn所得溶液中含有的金属离子,可知Zn置换出Cu、Cd,且将Fe3+转化为Fe2+;
(3)加入C后除去了溶液中Fe2+、Al3+,加入MnO2将Fe2+氧化为Fe3+,再调节溶液pH,使Fe3+、Al3+转化为沉淀而除去,并且不能引入杂质,另外物质可以是Zn(OH)2(Mn(OH)2、ZnCO3、MnCO3等;
(4)步骤④中电解过程中MnO2应在阳极生成,因Mn元素失去电子,阴极上Zn得到电子,得到的硫酸可循环使用.
解答 解:(1)结合与ZnS的反应可知,MnO2在酸性溶液与CuS反应生成硫酸铜、硫酸锰、S与水,MnO2在酸性溶液与FeS发生硫酸铁、硫酸锰、S与水,反应方程式分别为:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O,
故答案为:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O;MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O;
(2)由滤液A中加入Zn所得溶液中含有的金属离子,可知Zn置换出Cu、Cd,且将Fe3+转化为Fe2+,
故答案为:Cu、Cd;
(3)加入C后除去了溶液中Fe2+、Al3+,加入MnO2将Fe2+氧化为Fe3+,再调节溶液pH,使Fe3+、Al3+转化为沉淀而除去,并且不能引入杂质,另外物质可以是Zn(OH)2、Mn(OH)2、ZnCO3、MnCO3等,
故答案为:将Fe2+氧化为Fe3+;Zn(OH)2;
(4)因Mn元素失去电子,可知步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+,硫酸根离子不变,且生成氢离子,可知产品D的化学式为H2SO4,该物质对整个生产的意义是用于溶解软锰矿和闪锌矿,循环使用,
故答案为:阳;Mn2+-2e-+2H2O=MnO2+4H+;H2SO4;用于溶解软锰矿和闪锌矿,循环使用.
点评 本题考查混合物分离提纯的综合应用及物质制备实验,把握简化流程中的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=2 的H2C2O4 溶液与pH=12 的NaOH 溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| B. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | pH相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<c(NH4Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
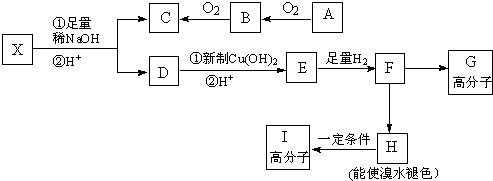
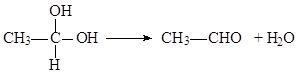
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性次序为c>b>a | |
| B. | 元素a和元素b、c均能形成共价化合物 | |
| C. | 元素d和元素b、c均能形成离子化合物 | |
| D. | 元素c最高和最低化合价的代数和为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
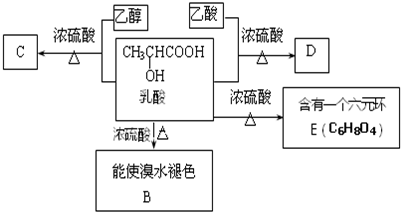
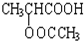 ;
;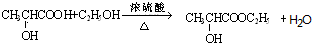 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X是Na,则Z 的最高价一定为偶数 | |
| B. | 若X是O,则YX一定是离子化合物 | |
| C. | 若Y是O,则非金属性:Z>Y>X | |
| D. | 若Y是Na,则X Z不可能是同一主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
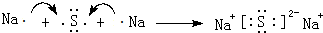
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | F | G | I | J |
| 化合价 | +1 | -2 | +5、-3 | +4、-4 | +7、-1 | +3 | +2 | +1 |
| 原子半/nm | 0.037 | 0.074 | 0.075 | 0.077 | 0.099 | 0.143 | 0.160 | 0.186 |
| A. | A、B组成的化合物与A、E组成的化合物中均可能含有非极性共价键 | |
| B. | 离子半径由大到小顺序是F>D>B>J>G | |
| C. | B、J组成的化合物一定属于离子化合物,它与水的反应可能是氧化还原反应 | |
| D. | 工业上生产G、I、J的单质均是通过电解它们的熔融氯化物实现的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com