
【题目】常温时,用![]() 滴定
滴定![]() 某一元酸HX,滴定过程中pH变化曲线如图所示。
某一元酸HX,滴定过程中pH变化曲线如图所示。

下列说法正确的是
A. HX溶液显酸性的原因是![]()
B. 点a,![]()
C. 点b,![]() 与
与![]() 恰好完全反应
恰好完全反应
D. 点c,![]()
【答案】D
【解析】
根据滴定曲线(特殊点)的含义,分析电解质强弱、电离与水解的主次关系,并运用物料守恒关系解答。
A项:滴入![]() 溶液前,0.10mol/LHX溶液pH接近4,则HX为弱酸,电离方程式为HX
溶液前,0.10mol/LHX溶液pH接近4,则HX为弱酸,电离方程式为HX![]() H++X-,A项错误;
H++X-,A项错误;
B项:点a溶液中生成1.5mmolNaX、剩余1.0mmolHX。因溶液呈酸性,HX电离程度大于X-的水解程度,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-),B项错误;
C项:当![]() 与
与![]() 恰好完全反应时生成NaX,因X的水解,溶液pH应大于7。点b的pH=7,必有HX剩余,C项错误;
恰好完全反应时生成NaX,因X的水解,溶液pH应大于7。点b的pH=7,必有HX剩余,C项错误;
D项:据物料守恒,曲线上任何一点都有n(X-)+n(HX)=25mL×0.10mol·L-1,点c溶液总体积约50mL,则![]() ,D项正确。
,D项正确。
本题选D。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.金属铝的冶炼流程为:铝土矿![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3![]() 无水AlCl3
无水AlCl3![]() Al
Al
C.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀,但加热反应剧烈
D.一定条件下,使用催化剂能加快反应速率但不提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随Cr含量的变化三种稀酸对Fe﹣Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
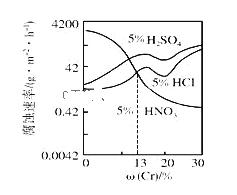
A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.酸对Fe﹣Cr合金的腐蚀与阴离子浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜![]() 、硒
、硒![]() 、碲
、碲![]() 外,还含有少量稀贵金属,主要物质为Cu、
外,还含有少量稀贵金属,主要物质为Cu、![]() 和
和![]() 。某铜沉淀渣的主要元素质量分数如下:
。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数 |
|
|
|
|
|
|
![]() 、
、![]() 、
、![]() 为同主族元素,其中
为同主族元素,其中![]() 在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
在元素周期表中的位置_________。其中铜、硒、碲的主要回收流程如下:
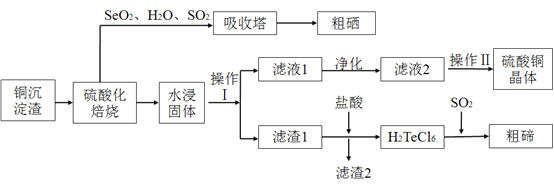
![]() 经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:
经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:![]() ____
____![]()
![]()
![]() ____
____![]() ____
____![]() ____
____![]()
![]() 与吸收塔中的
与吸收塔中的![]() 反应生成亚硒酸。焙烧产生的
反应生成亚硒酸。焙烧产生的![]() 气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为____________ ;
![]() 沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。滤液2经过_____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
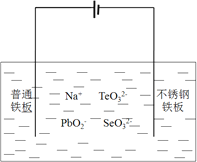
![]() 目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着
目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着![]() 浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 时
时
化学式 |
|
|
|
电离平衡常数 |
|
|
|
下列说法正确的是 ( )
A. 醋酸稀释过程中,![]() 逐渐减小
逐渐减小
B. ![]() 溶液中:
溶液中:![]()
C. 向醋酸或HCN溶液中加入![]() ,均产生
,均产生![]()
D. 物质的量浓度相同时![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
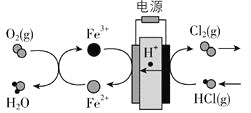
负极区发生的反应有_________![]() 写反应方程式
写反应方程式![]() 。电路中转移
。电路中转移![]() 电子,需消耗氧气__________
电子,需消耗氧气__________![]() 标准状况
标准状况![]() 。
。
![]() 电解法转化
电解法转化![]() 可实现
可实现![]() 资源化利用。电解
资源化利用。电解![]() 制HCOOH的原理示意图如下。
制HCOOH的原理示意图如下。

![]() 写出阴极
写出阴极![]() 还原为
还原为![]() 的电极反应式:________。
的电极反应式:________。
![]() 电解一段时间后,阳极区的
电解一段时间后,阳极区的![]() 溶液浓度降低,其原因是_____。
溶液浓度降低,其原因是_____。
![]() 可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接
可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接![]() 或
或![]() ,可交替得到
,可交替得到![]() 和
和![]() 。
。
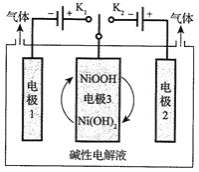
![]() 制
制![]() 时,连接_______________。产生
时,连接_______________。产生![]() 的电极反应式是_________。
的电极反应式是_________。
![]() 改变开关连接方式,可得
改变开关连接方式,可得![]() 。
。
![]() 结合
结合![]() 和
和![]() 中电极3的电极反应式,说明电极3的作用:___________。
中电极3的电极反应式,说明电极3的作用:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 ![]() 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应:![]()
![]() ,一段时间后达到平衡。反应过程中测定的数据如下表:
,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前 ![]() 的平均速率
的平均速率 ![]()
B.该温度下此反应的平衡常数 ![]()
C.其他条件不变,再充入 ![]() Z ,平衡时 X 的体积分数不变
Z ,平衡时 X 的体积分数不变
D.其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洗煤和选煤过程中排出的煤矸石(主要含Al2O3、SiO2及Fe2O3)会占用大片土地,造成环境污染。某课题组利用煤矸石制备聚合氯化铝流程如下:
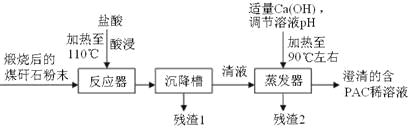
已知:聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
(1)酸浸的目的是___________________________;实验需要的500mL3.0 mol·L-1的盐酸,配制时所需要的玻璃仪器除量筒、烧杯、玻璃棒外还有______________________。
(2)若m=n=2,则生成PAC的化学方程式是_____________________。
(3)从含PAC的稀溶液中获得PAC固体的实验操作方法是_______、_________、_________。
(4)为了分析残渣2中铁元素的含量,某同学称取5.000g残渣2,先将其预处理使铁元素还原为Fe2+,并在容量瓶中配制成100mL溶液;然后移取25.00mL试样溶液,用1.000×10-2mol·L-1KMnO4标准溶液滴定,消耗标准溶液20.00mL。已知反应式为Fe2++MnO4-+H+—Fe3++Mn2++H2O(未配平)。判断滴定终点的依据是_______________________;残渣2中铁元素的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )
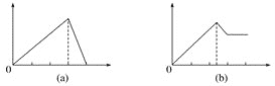
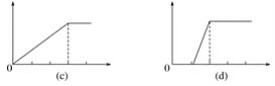
A.①-(d)B.②-(b)C.③-(c)D.④-(a)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com