
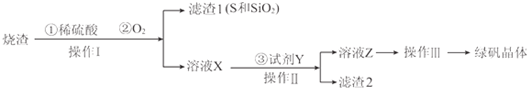
分析 硫酸厂烧渣与硫酸、氧气反应,过滤分离得到滤液X和不溶物I(S、二氧化硅等);滤液X主要为Fe2(SO4)3、H2SO4等,加入铁粉生成硫酸亚铁溶液,还可除去未反应的硫酸,过滤除去未反应的Fe,滤液为硫酸亚铁溶液,再通过浓缩蒸发、冷却结晶得到绿矾.
(1)对照操作Ⅰ前后的物质变化,可知操作Ⅰ是过滤;
(2)加入Fe将Fe3+还原为Fe2+,还可除去未反应的硫酸;
(3)Fe2+的检验可以用KSCN氯水法;
(4)操作Ⅲ是从溶液中获得晶体;
(5)①配制溶液,显然要用到容量瓶,应该注意容量瓶的规格;
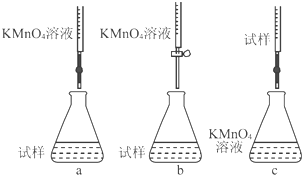
②高锰酸钾溶液具有强氧化性,能氧化橡胶管,应该用酸式滴定管,注意减少氧气的氧化;
③酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,自身被还原为Mn2+;
④高锰酸钾溶液本身是紫红色,不用添加指示剂,根据溶液颜色判断终点;滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,液面在刻度线下方,所读高锰酸钾溶液的体积偏小;
⑤根据消耗高锰酸钾计算n(Fe2+),而n(FeSO4•7H2O)=n(Fe2+),进而计算样品中FeSO4•7H2O的质量分数.
解答 解:硫酸厂烧渣与硫酸、氧气反应,过滤分离得到滤液X和不溶物I(S、二氧化硅等);滤液X主要为Fe2(SO4)3、H2SO4等,加入铁粉生成硫酸亚铁溶液,还可除去未反应的硫酸,过滤除去未反应的Fe,滤液为硫酸亚铁溶液,再通过浓缩蒸发、冷却结晶得到绿矾.
(1)操作Ⅰ是将互不相溶的固体与液体分离,可知操作Ⅰ是过滤,
故答案为:过滤;
(2)加入Fe将Fe3+还原为Fe2+,还可除去未反应的硫酸,反应离子方程式为:Fe+2Fe3+═3Fe2+、Fe+2H+═Fe2++H2↑,
故答案为:Fe+2Fe3+═3Fe2+、Fe+2H+═Fe2++H2↑;
(3)Fe2+的检验方法:将少许所得晶体放入KSCN溶液不变色,再向溶液中加入氯水变成红色,
故答案为:将少许所得晶体放入KSCN溶液不变色,再向溶液中加入氯水变成红色;
(4)操作Ⅲ是从溶液中获得晶体,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:蒸发浓缩、洗涤;
(5)①配制溶液,显然要用到容量瓶,需要1000mL容量瓶,
故答案为:1000mL容量瓶;
②高锰酸钾溶液具有强氧化性,能氧化橡胶管,应该用酸式滴定管,c装置与空气接触比较大,易被氧气氧化,故选:b;
③酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,自身被还原为Mn2+,反应离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,
故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;
④高锰酸钾溶液本身是紫红色,不用添加指示剂,滴加最后一滴KMnO4溶液时,溶液变成紫色且半分钟不再褪色,说明反应到达终点,
滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,液面在刻度线下方,所读高锰酸钾溶液的体积偏小,测定结果偏低,
故答案为:滴加最后一滴KMnO4溶液时,溶液变成紫色且半分钟不再褪色;偏低;
⑤25mL溶液消耗高锰酸钾为0.02L×0.01mol/L=0.0002mol,由5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,可知11.5g绿矾产品中n(Fe2+)=5×0.0002mol×$\frac{1000mL}{25mL}$=0.04mol,而n(FeSO4•7H2O)=n(Fe2+)=0.004mol,样品中FeSO4•7H2O的质量分数为$\frac{0.04mol×278g/mol}{11.5g}$×100%=96.7%,
故答案为:96.7%.
点评 本题考查物质的制备,涉及物质的分离提纯、溶液配制、氧化还原反应滴定、物质含量测定等,题目难度中等,关键是明确制备原理及化学实验基本操作.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | B. | Na+、Cl-、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、HCO${\;}_{3}^{-}$、H+ | D. | Ca2+、Na+、Fe3+、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | M | R |
| A. | 元素的非金属性次序为:Y>X>M | |
| B. | 气态氢化物稳定性:M>R | |
| C. | Z的氧化物可以做光导纤维 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-的水解方程式:CH3COO-+H2O?CH3COOH+OH- | |
| B. | HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | Fe3+的水解方程式:Fe3++3OH-?Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com