
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 2:3 |
分析 金属与酸反应时,金属失去电子,H得到电子,结合电子守恒及质量关系计算.
解答 解:n(氢气)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
设Fe为xmol,Al为ymol,则
$\left\{\begin{array}{l}{56x+27y=5.5}\\{2x+3y=0.2×2×(1-0)}\end{array}\right.$
解得x=0.05mol,y=0.1mol,
则混合物中Fe与Al的物质的量之比为0.05mol:0.1mol=1:2,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子守恒及质量关系为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同质量的C和D单质分別与足量稀盐酸反应时,后者生成的氢气多 | |
| B. | C与D的最高价氧化物对应的水化物的碱性相比,后者更强 | |
| C. | 不用电解氯化物的方法制备单质D是由于其氯化物的熔点高 | |
| D. | 简单离子半径:B<C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
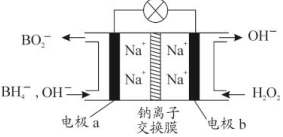 某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法不正确的是( )| A. | 每消耗3mol H2O2,转移6mol e- | |
| B. | 电池工作时Na+从b极区移向a极区 | |
| C. | b极上的电极反应式为:H2O2+2e-═2OH- | |
| D. | a极上的电极反应式为:BH4-+8OH--8e-═BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
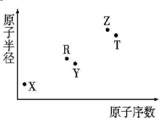 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍.下列推断正确的是( )| A. | X和Y组成的化合物的水溶液保存在塑料瓶中 | |
| B. | 原子半径和离子半径均满足:Y<Z | |
| C. | 最高价氧化物对应的水化物酸性:Z>T | |
| D. | 含Z元素的盐溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | 将 0.1 mol•L-1NH4A1(SO4)2 溶液与 0.3 mol•L-1Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++40H-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com