
| A. | 碱性:Ca(OH)2>Mg(OH)2 | B. | 酸性:H2SO3>H2CO3 | ||
| C. | 热稳定性:NH3<PH3 | D. | 还原性:S2-<Cl- |
分析 A.金属性越强,对应碱的碱性越强;
B.非金属性越强,对应最高价含氧酸的酸性越强;
C.非金属性越强,对应氢化物越稳定;
D.非金属性越强,对应阴离子的还原性越弱.
解答 解:A.金属性Ca>Mg,对应碱的碱性为Ca(OH)2>Mg(OH)2,故A正确;
B.非金属性S>C,对应最高价含氧酸的酸性为H2SO4>H2CO3,而H2SO3>H2CO3可利用强酸制取弱酸反应说明,故B错误;
C.非金属性N>P,对应氢化物的稳定性为NH3>PH3,故C错误;
D.非金属性S<Cl,对应阴离子的还原性为S2->Cl-,故D错误;
故选A.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 核外电子排布相同的微粒化学性质相同 | |
| B. | 非金属的气态氢化物的稳定性越强其沸点就越高 | |
| C. | 同主族元素形成的单质熔、沸点随元素核电荷数的递增而逐渐降低 | |
| D. | 同主族非金属元素最高价氧化物对应水化物的酸性随核电荷数的增加而减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
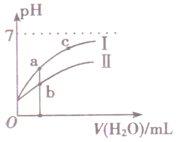 如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| A. | 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 等浓度等体积的CH3COONa和NaClO两种溶液中,阴离子的总物质的量前者小于后者 | |
| C. | 图中a、b两点对应的酸的物质的量浓度a>b | |
| D. | 图中a、c两点的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 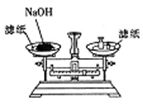 称取一定的NaOH | |
| B. | 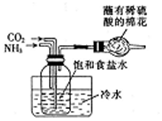 制取Na2CO3 | |
| C. | 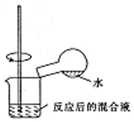 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 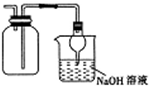 收集NO2并防止其污染环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
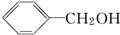 ,B
,B .
. .
. →2
→2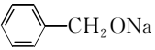 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
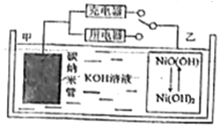 氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )
氢燃料电池具有广阔前景.某二次氢燃料电池的原理如图所示,该电池用吸附了H2的碳纳米管等材料制作而成,下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 可开发氢燃料电池用于电动汽车 | |
| C. | 电池总反应为H2+NiO(OH)$?_{充电}^{放电}$Ni(OH)2 | |
| D. | 充电时,乙电极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
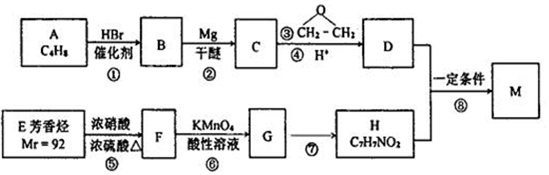
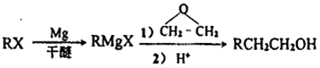
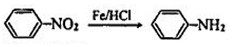 (苯环上的-NH2易被氧化).
(苯环上的-NH2易被氧化).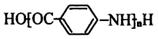 .
.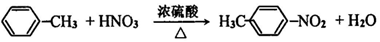 .
. .
. .
.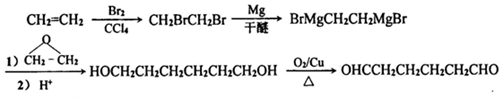 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜作阳极 | |
| B. | 用CuSO4溶液作电解液 | |
| C. | 阴极的电极反应式:Cu2++2e-=Cu | |
| D. | 当阳极质量减少ag时,阴极质量增加ag |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡时,放出热量为QkJ | |
| B. | 若容器的压强不再发生交化,则反应达到平衡 | |
| C. | 反应过程中c(SO2)+c(SO3)=1 mol•L-1恒成立 | |
| D. | 平衡时,SO2、O2的转化率相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com