
分析 依据反应体系中的物质Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O,K2S2O8的氧化性比K2Cr2O7强,所以K2S2O8是氧化剂,K2SO4、H2SO4是还原产物,Cr2(SO4)3是还原剂,K2Cr2O7是氧化产物,分析反应物中元素化合价变化,依据得失电子守恒规律、原子个数守恒规律配平方程式.
解答 解:依据反应体系中的物质Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O,K2S2O8的氧化性比K2Cr2O7强,所以K2S2O8是氧化剂,K2SO4、H2SO4是还原产物,Cr2(SO4)3是还原剂,K2Cr2O7是氧化产物,K2S2O8→K2SO4、H2SO4硫元素化合价降低1,Cr2(SO4)3→K2Cr2O7铬元素化合价升高3,依据得失电子守恒规律
K2S2O8系数为3,Cr2(SO4)3系数为1,依据原子个数守恒,反应方程式:
7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7,
故答案为:7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7.
点评 本题考查了氧化还原方程式的书写,明确物质氧化性、还原性强弱规律,依据得失电子守恒、原子个数守恒即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题:
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题: HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.
HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.(用方程式回答).对于质疑可以采用对比实验解决.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,预测该芳香烃能(填“能”或“不能”)发生该类反应.
,预测该芳香烃能(填“能”或“不能”)发生该类反应.
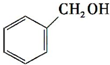 c.
c.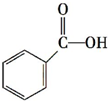
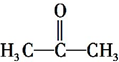
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂试剂 | 反应条件或除杂方法 |
| A | 苯 | 乙酸 | 烧碱溶液 | 分液 |
| B | 硅 | 铝 | 稀盐酸 | 过滤 |
| C | 氯气 | 氯化氢 | 饱和食盐水 | 洗气 |
| D | 乙烷 | 乙烯 | 氢气 | 催化剂、加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若 Vl>V2,则说明HA的酸性比 HB的酸性强 | |
| B. | 中和后得到的两种溶液的pH均为 7 | |
| C. | 分别将两种酸溶液稀释10 倍后溶液的pH均为3 | |
| D. | 分别往等体积的两种酸溶液中加人足量锌粉,充分反应后产生的H2的体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为14NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com