
| A. | 银氨溶液 | B. | 金属钠 | C. | 氧气 | D. | 新制氢氧化铜 |
科目:高中化学 来源: 题型:选择题
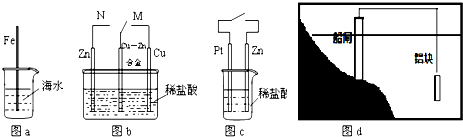
| A. | 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| C. | 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 图d中,船闸采用的是牺牲阴极的阳极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应和逆反应的速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
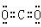
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | CH3CH(OH)COOH | C. | HOOC-COOH | D. | HO-CH2-CH2-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式分别为C2H4和C4H8的两种有机物一定是同系物 | |
| B. | 同一种分子式可能代表不止一种物质 | |
| C. | 苯的产量是石化工业发展水平的标志 | |
| D. | 烷烃的通式是:CnH2n+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com