
用下列实验装置进行相应实验,能达到实验目的的是( )
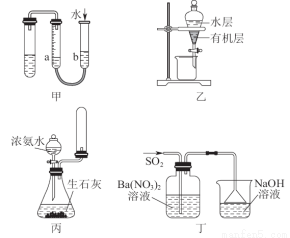
A.用图甲的方法不能检查此装置的气密性
B.图乙可以作为CCl4萃取溴水后的分液装置
C.实验室用图丙所示装置制取少量氨气
D.图丁洗气瓶中的白色沉淀为BaSO3
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:推断题
某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且能够防止环境污染,现按以下方式进行处理利用:

试回答:
(1)A的名称是____________;
(2)写出D的同分异构体的结构简式____________。
(3)D到E的反应类型为____________,D到E的反应试剂可以为____________。
(4)实验室制备H后,提纯H的分离方法为____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:选择题
分析原子的杂化方式,并根据等电子体原理判断下列各组分子中的所有原子,或者处于同一平面,或者在一条直线上的是( )
A.C2H2、HClO、C2H6 B.CO2、N2O、HC≡CH
C.C6H5CH3、C3H4、CH4 D.C6H6、C2H4、HCN
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用不相对应的是
A. 氨气能与氯气生成氯化铵,可用浓氨水检验输送氯气的管道是否泄漏
B.SO2有强还原性,用 SO2漂白纸浆
C.熟石膏与水的糊状混合物会很快凝固,可用它制作模型和石膏绷带
D.铝有强还原性且转化为氧化铝时放出大量的热,可用铝粉来还原某些金属氧化物
查看答案和解析>>
科目:高中化学 来源:2016届青海省西宁市等校高三下联考理综化学试卷(解析版) 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(假设杂质中不含铁元素和氧元素,且杂质不与稀硫酸反应)。某研究性学习小组对某铁矿石中铁的价态和氧化物的化学式进行探究。
[提出假设]
假设1:铁矿石中只含+3价铁;
假设2:铁矿石中只含+2价铁;
假设3:_____________________________________________。
[查阅资料]2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
[定性探究]
实验(一)
取铁矿石样品粉碎,盛装于烧杯中,加入适量的X溶液,微热,充分溶解后将滤液分成四份:
①向第一份溶液中滴加少量KSCN溶液;
②向第二份溶液中滴加适量高锰酸钾溶液;
③向第三份溶液中滴加少量KSCN溶液,再滴加适量过氧化氢溶液;
④向第四份溶液中滴加适量氢氧化钠溶液。
(1)上述X溶液是________(填“稀硝酸”“稀硫酸”或“浓盐酸”);上述方案中,一定能证明铁矿石中含+2价铁的方案是________(填序号)。
[定量探究]
实验(二) 铁矿石中含氧量的测定:
①按图组装仪器,检查装置的气密性;
②将5.0 g铁矿石放入硬质玻璃管中,其他装置中的药品如图所示(夹持装置已略去);
③A中开始反应,不断地缓缓向后续装置中通入氢气,待D装置出口处氢气验纯后,点燃C处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气直至完全冷却。
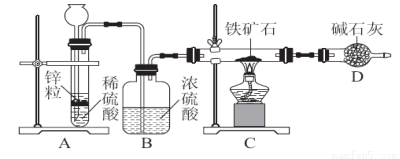
(2)按上述方案进行多次实验,假设各项操作都正确,但最终测得结果都偏高,请你提出改进方案的建议:____________________________________________________。
如果拆去B装置,测得结果可能会________(填“偏高”“偏低”或“无影响”)。
(3)改进方案后,测得反应后D装置增重1.35 g,则铁矿石中氧的百分含量为________。若将H2换成CO,则还需补充________装置。
实验(三) 铁矿石中含铁量的测定:
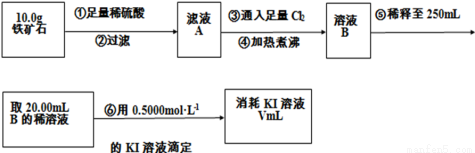
(4)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、______________。
(5)步骤④中煮沸的作用是_________________________________________。
(6)若滴定过程中消耗0.500 0 mol·L-1的KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:简答题
【化学——选修化学与技术】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:

已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为:2Na2SiO3+2NaAlO2+4H2O=Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
(1)溶解铝土矿时,发生反应的离子方程式为:____________。
(2)滤渣A的主要成分________;硅铝酸盐沉淀写成氧化物的形式是________。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 _。
(4)若该工厂用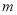 kg铝土矿共制得
kg铝土矿共制得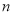 kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
kg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为______。
(5)若将铝溶解,下列试剂中最好选用_____ __(填编号)。
A.浓硫酸B. 稀硫酸C.稀HNO3 D.浓HNO3
(6)电解冶炼铝时用Na3AlF6作助熔剂, Na3AlF6是配合物,其中内界是___,配位数为_ ____。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:选择题
某有机原料的结构简式如图: 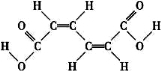 下列有关该有机物的叙述正确的是
下列有关该有机物的叙述正确的是
A.已知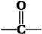 为平面结构,则该有机物分子中最多有16个原子在同一平面内。
为平面结构,则该有机物分子中最多有16个原子在同一平面内。
B.1mol该有机物可以和2mol NaOH反应,但不能用Na2CO3溶液区分该有机物和CH3COOCH2CH3[
C. 该有机物能发生加成反应不能发生取代反应
D. 该有机物与乙酸互为同系物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:实验题
某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g·mL﹣1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1) 加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是 混合液体时最后加入浓硫酸的理由: 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点最好采用装置 (填“甲”或“乙”或“丙”)。
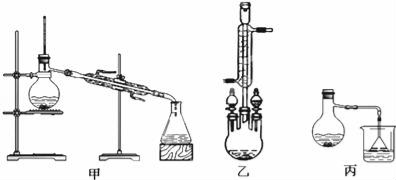
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称,操作Ⅱ 。


(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是 。
(6)列式计算,苯甲酸甲酯的产率是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一下期中化学试卷(解析版) 题型:选择题
有一种MCFC型氢氧燃料电池,电解质为熔融的K2CO3。电池的总反应为:2H2+O2=2H2O,负极反应为H2 + CO32--2e-= H2O + CO2下列说法中正确的( )
A.正极反应为4OH--4e-= 2H2O + O2↑
B.放电时CO32-向负极移动
C.电池放电时,电池中CO32-的物质的量将逐渐减少
D.电路中电子由负极、经熔融的K2CO3流到正极,形成闭合回路
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com