
铬能慢慢地溶于稀盐酸得到蓝色溶液,若通入空气则溶液颜色变绿,发生的反应有①Cr+2HCl===CrCl2+H2↑;②4CrCl2+4HCl+O2===4CrCl3+2H2O,下列叙述中正确的是( )
A.反应①、②均属于置换反应
B.HCl在反应①、②中均做氧化剂
C.反应①中HCl被氧化
D.溶液颜色由蓝变绿是因为Cr2+发生氧化反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
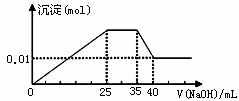
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+)n(Al3+)n( NH4+)=112
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )
A.利用电池外壳的金属材料
B.回收其中石墨电极
C.防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D.不使电池中泄漏的电解液腐蚀其他物品
查看答案和解析>>
科目:高中化学 来源: 题型:
请你设计一个能证明铁的金属活动性比铜强的实验。要求:
①此方案能将化学能转化为电能;
②绘出实验装置图并注明所需的药品;
 ③写出实验过程中的主要实验现象。
③写出实验过程中的主要实验现象。
实验装置
实验现象:______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中迅速制备少量氯气可利用如下反应:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
此反应在常温下就可以迅速进行,而且对盐酸浓度要求不高。
(1)已知高锰酸钾和氯化锰都属于可溶性盐,请把上述化学方程式改写为离子方程式:________________________________________________________________________。
(2)该反应中,氧化剂是________,还原剂是________。当有1 mol氧化剂参加反应时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积约为________。
(3)HCl在此反应过程中表现出的化学性质有________。
A.酸性 B.还原性
C.氧化性 D.挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
大气中的臭氧层可使人类和其他生物免受紫外线的危害,人为因素可能使臭氧层受到破坏,下列因素可破坏臭氧层的是( )
A.SO2的排放
B.制冷剂氟氯烃(商品名氟利昂)的泄漏
C.CO2的排放
D.燃料的不完全燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种新型的汽车动力燃料,工业上可通过CO(CO的结构式为
C≡O)和H2化合制备甲醇,该反应的热化学方程式为
①CO(g)+2H2(g)====CH3OH(g) ΔH1
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为
②CO(g)+1/2O2(g)====CO2(g) ΔH2=-283 kJ·mol-1
③H2(g)+1/2O2(g)====H2O(g) ΔH3=-242 kJ·mol-1
断开1 mol某些化学键所需的最低能量数据如下表,请回答下 列问题:
列问题:

(1)反应① 的焓变ΔH1=_________。
的焓变ΔH1=_________。
(2)CH3OH(g)燃 烧生成CO2(g)和H2O(g)的热
烧生成CO2(g)和H2O(g)的热 化学方程式为CH3OH(g)+3/2O2(g)
化学方程式为CH3OH(g)+3/2O2(g)
====CO2(g)+2H2O(g) ΔH4,该反应的焓变ΔH4=______________________。
与CO和H2相比,甲醇作为汽车动力燃料的优点是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com