
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NH3、CO、CO2都是极性分子 | |
| B. | H2O、D2O、T2O互为同分异构体 | |
| C. | CH4、CCl4都是含有极性键的非极性分子 | |
| D. | HF、HCl、HBr、HI的稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲 | B. | 乙 | C. | 丙 | D. | 丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、OH-、CH3COO- | B. | Na+、Ba2+、CO32-、NO3- | ||
| C. | Na+、NH4+、Cl-、HCO 3- | D. | Fe3+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中的氧化剂是Cu2O | |
| B. | 氧化产物和还原产物的物质的量之比为1:6 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | Cu2S在反应中仅做氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 铁比铜金属性强 | 刻制印刷电路板 |
| C | 次氯酸盐具有氧化性 | 作杀菌消毒剂 |
| D | 二氧化硫具有漂白性 | 漂白纸浆 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
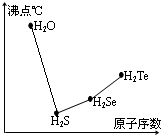 氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.
氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.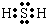 .在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.
.在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com