
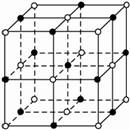
. ①下图为NaCl晶体结构示意图。在该晶体中每个Na+ 周围与之最接近且距离相等的Na+ 共有 个;与每个Na+等距离且最近的Cl-所围成的空间几何构型为 。

②在干冰晶体中,每个CO2分子周围与之最接近的且距离相等的CO2分子有 个
③。在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有 个碳原子,每个碳原子上的任意两个C—C键的夹角都是 。
④水分子间由于氢键的作用彼此结合而形成 (H2O)n,在冰中每个水分子被 个水分子包围形成变形的 ,通过氢键相互连接成晶体,则1 mol冰中有 mol氢键。
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
?
(1)请将其代表Na+的用笔涂黑圆点,以完成 NaCl晶体结构示意图。并确定晶体的晶胞,分析其构成。?
(2)从晶胞中分Na+周围与它最近时且距离相等的 Na+共有多少个??
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省惠州市高考模拟考试理综化学试卷(解析版) 题型:填空题
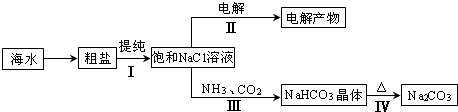
利用海水资源进行化工生产的部分工艺流程如图:

(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
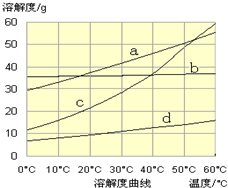
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。

(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3•10H2O,Na2CO3•10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com