
【题目】能正确解释下列反应原理,并且书写的离子方程式正确的是( )
A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C.电解MgCl2饱和溶液制取Mg:MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
D.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3+SO42-
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
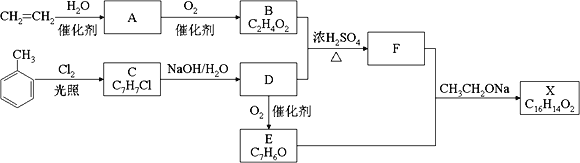
已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’ 请回答:
RCH=CHCOOR’ 请回答:
(1) A中官能团的名称是______________________。
(2) D→E的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4)与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为_____。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)已知钴属于铁系元素,其单质与化合物的性质与铁相似,其常见化合价有+2和+3,则Co3O4与浓盐酸反应能生成黄绿色气体的离子方程式_________________。
(2)碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
已知25℃,101kPa时: 4Fe(s)+3O2(g)=2Fe2O3(s) △H=1648kJ/mol
C(s)+O2(g)=CO2(g) △H=393kJ/mol
2FeCO3(s)=2Fe(s)+2C(s)+3O2(g) △H=+1480kJ/mol
写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式______________。
(3)将标准状况下1.344L Cl2通入100mL0.5mol/lFeI2溶液中的离子方程式为_____________。
(4)1mol·L-1的NaAlO2溶液和3.0mol·L-1的HCl溶液等体积混合的离子方程式为________________
(5)用于驱动潜艇的液氨-液氧燃料电池示意图如图所示:
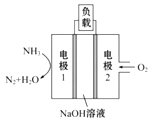
则电极1的电极反应式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
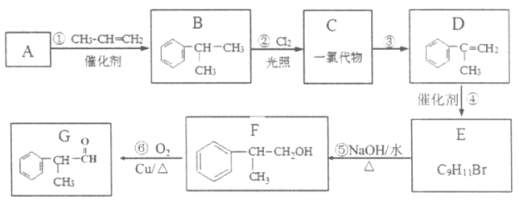
【题目】某物质G可做香料,其结构简式为![]() ,工业合成路线如下:
,工业合成路线如下:
已知:
Ⅰ. 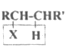
![]() RCH=CHR'
RCH=CHR'
Ⅱ.RCH2X+NaOH![]() RCH2OH+NaX
RCH2OH+NaX
(R、R'为烃基或H原子,X为卤素原子)
回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是____(填序号)。
a.密度比水大
b.所有原子均在同一平面上
c.一氯代物只有一种
(2)反应①的反应类型为__________反应。
(3)C的核磁共振氢谱显示有4组峰,步骤②的化学方程式是__________。
(4)③的反应条件是__________。
(5)④为加成反应,E的核磁共振氢谱显示有6组峰,步骤④的化学方程式是_______。
(6)步骤⑤的化学方程式是__________。
(7)下列说法正确的是__________。
a.上述框图中方框内所有物质均为芳香族化合物
b.D存在顺反异构
c.反应②和⑤都是取代反应
(8)反应⑥中Cu是反应的催化剂,该反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径和主要化合价如表所示,下列说法正确的是( )
元素代号 | 原子半径/nm | 主要化合价 |
X | 0.160 | +2 |
Y | 0.143 | +3 |
Z | 0.102 | +6、﹣2 |
L | 0.099 | +7、﹣1 |
M | 0.077 | +4、﹣4 |
Q | 0.074 | ﹣2 |
A.等物质的量的X、Y的单质与足量的盐酸反应,生成![]() 的物质的量相等
的物质的量相等
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
D.Z的简单氢化物的稳定性强于L的简单氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)只含有离子键的是______(填序号,下同)
(2)含有共价键的离子化合物是______,其中含有非极性共价键的物质的电子式为______。
(3)属于共价化合物的是______。
(4)熔融状态下能导电的化合物是______。
(5)熔融状态下和固态时都能导电的物质是______。
(6)用电子式表示![]() 的形成过程:______。
的形成过程:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2固体(溶液体积变化、温度变化忽略不计),测得溶液中离子浓度的关系如图所示,下列说法正确的是( )

已知:Ksp(BaCO3)=2.40![]() 10-9
10-9
A.A、B、C三点对应溶液pH的大小顺序为:A>B>C
B.A点对应的溶液中存在:c(CO32-)< c(HCO3-)
C.B点溶液中 c(CO32-)=0.24mol/L
D.向C点溶液中通入CO2可使C点溶液向B点溶液转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。

已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子质量 | 溶解性 |
苯甲醛 | 178.1 | 1.04 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.04 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |
实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。

(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
编号 | 基本信息 | 解决的问题 |
① | 其中两种元素的原子核外电子层数与最外层电子数之比分别为 | 这两种元素分别是______(填元素符号,下同)、______. |
② | 其中一种元素的氧化物与强酸、强碱均能反应;另一种元素的单质、氧化物及氧化物对应的水化物均能与NaOH溶液反应 | 这两种元素分別是______、______. |
③ | G能与A、E分别形成原子个数比均为 | X的分子式为______, |
(1)仅由表中信息还不能确定的元素是______(填字母序号),若要确定其是何种元素,还需要的条件是______(填序号).
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
e.单质在常温下为固体
d.简单氯化物的稳定性比![]() 的简单氯化物强
的简单氯化物强
(2)基本信息②中,两种元素的氧化物分别与NaOH溶液反应的离子方程式为__________________,__________________.
(3)上述某两种元素间可形成原子个数比为![]() 及
及![]() 的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
的两种能与水反应的常见化合物,写出前者与H2O反应的离子方程式:__________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com