
【题目】某溶液中含有四种离子,已知其中三种离子Na+、Mg2+、NO3﹣的物质的量浓度分别为0.2molL﹣1 , 0.1molL﹣1 , 0.1molL﹣1 , 则溶液中另一离子及其物质的量浓度可能是( )
A.SO42﹣ 0.1 molL﹣1
B.Al3+ 0.2 molL﹣1
C.Cl﹣ 0.3 molL﹣1
D.K+ 0.4 molL﹣1
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH的电离常数K=1.6×10-5,1g4=0.6。该温度下,向20mL0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法正确的是
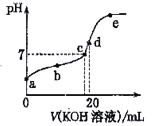
A. 滴定过程中宜选用甲基橙作指示剂
B. a点溶液中c(H+)为1×10-4 mol·L-1
C. a、b、c、d、e四点中水的电离程度最大的是e点
D. d 点时溶质的水解常数为6.25×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)混合气体中碳原子的个数________。(用NA表示阿伏加德罗常数的值)
(2)该混合气体的平均摩尔质量________g/mol。
(3)将混合气体依次通过如图装置,最后收集在气球中。气球中收集到的气体是________,标准状况下气球中收集到的气体的体积为________L,如果上述装置中使用的浓硫酸失效,则气球中气体的相对分子质量会________(填“变大”、“变小”或“不受影响”)。
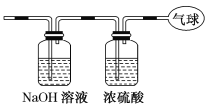
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 明矾能水解生成Al(OH)3胶体,可用作净水剂
B. 除去MgCl2酸性溶液中的Fe3+,可加入MgCO3固体
C. SO2具有氧化性,可用于漂白纸浆
D. Zn具有还原性和导电性,可用作锌锰干电池的负极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
B.钠可以从AgNO3溶液中置换出金属银
C.钠能与水反应,所以钠着火不能用水灭火,要用泡沫灭火器
D.Na2O、Na2O2、NaOH和NaHCO3均是强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)下列有关化学实验安全问题的叙述中不正确的是( )
A.少量的浓硫酸或浓NaOH沾到皮肤上,应用大量的水反复冲洗,再涂抹相应的药品
B.氢气还原氧化铜,一般先预热氧化铜,然后再通入氢气
C.浓硝酸需用细口棕色试剂瓶密封保存
D.实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)最高正价为+1价,还能显﹣1价的元素是____(填元素符号);⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为________(填化学式).
(2)③的单质在空气中充分燃烧的化学方程式是________________________________.④与⑥形成的稳定化合物的电子式为______________.
(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为________________,其中含有的化学键类型为_________________.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈___色.⑤的最高价氧化物水化物的稀溶液与金属铜反应的离子方程式为______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某温度下纯水pH=6,则在该条件下pH=4的醋酸和pH=10的NaOH中水的电离程度相同
B. NH4Cl溶于D2O的离子方程式:NH![]() +D2O
+D2O![]() NH3·D2O+H+
NH3·D2O+H+
C. 已知S的燃烧热为Q kJ·mol-1,则S(s)+![]() O2(g)===SO3(g) ΔH=-Q kJ·mol-1
O2(g)===SO3(g) ΔH=-Q kJ·mol-1
D. 水的自偶电离方程式:2H2O![]() H3O++OH-,则液氨自偶电离方程式:2NH3
H3O++OH-,则液氨自偶电离方程式:2NH3![]() NH
NH![]() +NH
+NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组利用乙炔与酸性KMnO4溶液反应,测定乙炔的相对分子质量。下图是测定装置示意图。该小组实验如下:实验前,D装置中KMnO4的物质的量为xmol。实验完毕,D及E装置的总质量共增重yg,此时D中过量的KMnO4恰好能与含zmol FeSO4的溶液完全反应(注:反应中MnO4-被还原成Mn2+,Fe2+被氧化成Fe3+),通过计算即可测出乙炔的相对分子质量。

(1)实验室制取乙炔时,分液漏斗中的液体a通常是_________________。
(2)CuSO4溶液的作用是_____________________。
(3)配平乙炔与酸性KMnO4溶液反应的化学方程式(请在方框中填计量系数):
□C2H2+□KMnO4+□H2SO4—□K2SO4+□MnSO4+□CO2↑+□H2O_______________
(4)若该小组实验原理及所有操作均正确,则下列各因素对所测乙炔的相对分子质量没有影响的是(填选项)____________。
A.装置A中产生的气体直接通入酸性KMnO4溶液
B.乙炔通过酸性KMnO4溶液的速率过快,少量乙炔未被氧化而逸出
C.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
(5)另一课外小组认为,该课外小组的实验装置及实验操作存在不足,请用简明文字说明,应采取何种措施或改进?答:___________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com