
| A. | 甲溶液含有Cl- | B. | 乙溶液含有Mg2+ | C. | 丙溶液含有Ba2+ | D. | 丁溶液含有SO42- |
分析 向甲溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明甲中含有Cl-;将丙溶液分别与其他三种物质的溶液混合,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,因此丙只能是Ba(OH)2,1mol/L丁溶液中c(H+)=2mol/L,说明丁是硫酸;根据离子间的共存可知甲为MgCl2,乙是NH4HCO3 .
解答 解:①向甲溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明甲中含有Cl-;②将丙溶液分别与其他三种物质的溶液混合,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,因此丙只能是Ba(OH)2,③1mol/L丁溶液中c(H+)=2mol/L,说明丁是硫酸;根据离子间的共存可知甲为MgCl2,乙是NH4HCO3 则可推出甲是MgCl2,乙是NH4HCO3,丙是Ba(OH)2,丁是H2SO4,B错误,故选B.
点评 本题为推断题,做题时注意题中的反应现象,找出突破口,抓住物质的性质是关键,题目难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素原子的电子层数呈周期性变化 | |
| B. | 元素原子的核外电子排布呈周期性变化 | |
| C. | 元素的化合价呈周期性变化 | |
| D. | 元素原子半径呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③② | B. | ①②③ | C. | ②③① | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水变成水蒸气 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ④ | ⑦ | ⑧ | ⑩ | ||||
| 3 | ② | ③ | ⑤ | ⑥ | ⑨ |
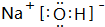 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
现欲用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硬度比生铁低 | B. | 在潮湿空气中放置不易生锈 | ||
| C. | 可溶在稀H2S04中 | D. | 熔点比生铁低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com