
| A. | 氧族元素包括氧、硫、锡、碲、钋 | |
| B. | Na2O2固体中的阳离子和阴离子个数比为1:1 | |
| C. | H、D、T、H+可以用来表示氢元素的四种同位素 | |
| D. | 表示金属元素名称的汉字不一定都含“钅”旁 |
分析 A.氧族元素包括氧、硫、硒、碲、钋;
B.Na2O2固体中的阳离子是Na+,阴离子是O22-(过氧根);
C.质子数相同、中子数不同的同种元素的不同原子互为同位素;
D.金属元素除金、汞外,其他都是“钅”旁;
解答 解:A.氧族元素包括氧、硫、硒、碲、钋,注意硒与锡元素的名称的区别,故A错误;
B.Na2O2固体中的阳离子是Na+,阴离子是O22-(过氧根),阳离子和阴离子个数比为2:1,故B错误;
C.H、D、T表示氢的同位素,H+表示氢离子,可以说成:H、D、T、H+可以用来表示氢元素的四种不同微粒,故C错误;
D.元素名称的中文书写的特点:金属元素除金、汞外,其他都是“钅”旁,表示金属元素名称的汉字不一定都含“钅”旁,故D正确;
故选D.
点评 本题考查常见元素的名称、符号、离子符号的书写,注意过氧化钠的构成离子,同位素概念的实质理解应用,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:填空题
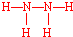 ,过氧化氢的电子式
,过氧化氢的电子式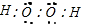 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | T1(OH)3是两性氢氧化物 | B. | 铊与酸反应比铝更剧烈 | ||
| C. | Tl3+的氧化能力比Al3+弱 | D. | 铊是易导电的银白色金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

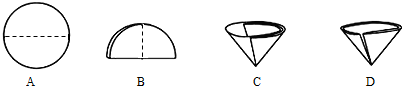
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未充分加热 | B. | 加入葡萄糖太多 | ||
| C. | 加入NaOH溶液的量不够 | D. | 加入CuSO4溶液的量不够 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素. ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族. ,R、T的氢化物的稳定强的HCl(填化学式)
,R、T的氢化物的稳定强的HCl(填化学式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
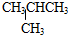
 和
和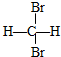
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
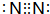 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com