
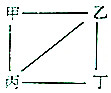 X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(图中“-”相连的两种物质能发生反应).下列判断一定正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最大 | |
| D. | W的最高化合价为+7 |
分析 Y、Z为金属元素,由转化关系可知对应的最高价氧化物对应的水化物可发生反应,由原子序数关系可知Y为Na、Z为Al,则乙为NaOH,丙为Al(OH)3,甲、丁应为含氧酸,由原子序数关系可知X为N元素,甲为HNO3,W可能为S、Cl等元素,丁可为硫酸、高氯酸,以此解答该题.
解答 解:由以上分析可知X为N、Y为Na、Z为Al、W可能为S、Cl等元素,
A.X为N元素,如为非金属性最强的元素,应为F,则无正价,故A错误;
B.Z为Al、位于周期表第三周期ⅢA族,故B错误;
C.Y为Na,为短周期半径最大的元素,故C正确;
D.如W为S,则最高化合价为+6价,故D错误.
故选C.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力,注意把握物质的性质以及转化关系,本题突破口为乙、丙的反应,难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g | B. | 5.6 g | C. | 11.2 g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
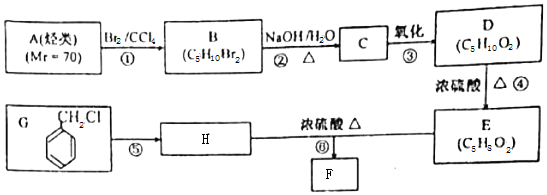
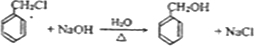 .
. .
. 写出其中一种.
写出其中一种.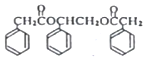 .(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
.(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)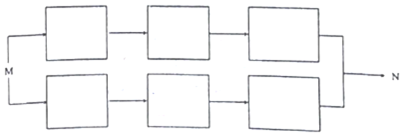
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
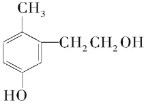
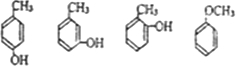
| A. | 它是苯酚的同系物 | |
| B. | 1 mol该物质能与溴水反应消耗2molBr2发生取代反应 | |
| C. | 1 mol该有机物能与足量金属钠反应生成0.5mol H2 | |
| D. | 1 mol该有机物能与2molNaOH反应 | |
| E. | 该物质在加热条件下可以与铜反应生成一种具有醛基的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计 | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 | |
| C. | 用50 mL 0.55 mol•L-1的NaOH溶液与60 mL 0.50 mol•L-1的盐酸反应,测得的中和热数值偏大 | |
| D. | 使用环形玻璃搅拌棒是为了加大反应速率,减小实验误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H1 | B. | 2CO(g)+O2(g)═2CO2(g)△H2 | ||
| C. | S(s)+$\frac{3}{2}$O2(g)═SO3(s)△H3 | D. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com