
【题目】某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是________。
第1组 | 第2组 | 第3组 |
S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2 -76.1 ℃,SO3 16.8 ℃;沸点:SO2 -10 ℃,SO3 45 ℃)
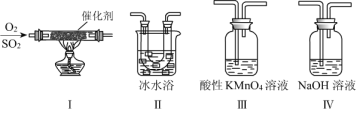
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是__________________。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是_____________________;装置Ⅳ的作用是_________________。
③装置Ⅲ中溶液逐渐褪色,说明SO2具有__________性
【答案】H2SO3 2SO2+O2 ![]() 2SO3 使SO3凝结成固体与SO2分离 吸收多余的硫氧化物,避免污染空气 还原
2SO3 使SO3凝结成固体与SO2分离 吸收多余的硫氧化物,避免污染空气 还原
【解析】
(1)将相关的含硫物质依据硫元素化合价分组,依据第三组分类顺序,判断X为+4价的酸为H2SO3 ;
(2)①工业生产中利用SO2的催化氧化制备SO3;
②装置II是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置III中高锰酸钾溶液能氧化二氧化硫生成硫酸;
③SO2有还原性,能被酸性高锰酸钾溶液氧化。
(1)将相关的含硫物质依据硫元素化合价分组,依据第三组分类顺序,判断X为+4价的酸为H2SO3 ;
(2)①工业生产中利用SO2的催化氧化制备SO3,化学方程式为:2SO2+O2 ![]() 2SO3;
2SO3;
②装置II是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置III利用高锰酸钾的强氧化性,吸收硫氧化物,避免污染空气;
③装置III中高锰酸钾溶液紫色褪去,是高锰酸钾氧化二氧化硫生成硫酸的缘故,体现了SO2的还原性。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】在SO2分子中,分子的立体构型为V形,S原子采用sp2杂化,那么SO2的键角
A. 等于120°B. 大于120°
C. 小于120°D. 等于180°
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加2mol·L-1NaOH溶液的体积为
A. 40mL B. 72mL C. 80mL D. 128mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列装置或操作说法错误的是
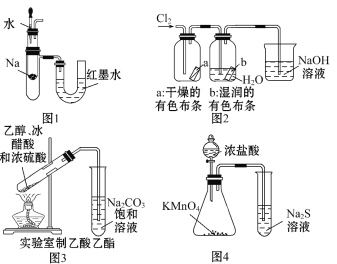
A. 图1中:将胶头滴管中的水滴入到金属钠中,能看到U形管右侧红墨水高度不变
B. 图2中:观察到湿润的有色布条能褪色,待尾气全部被碱吸收后,将稀硫酸滴入烧杯中,至溶液显酸性,可能看到有黄绿色气体生成
C. 图3可用于制备乙酸乙酯
D. 图4可以比较KMnO4、Cl2和S氧化性的相对强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室产生的废液中含有大量会污染环境的物质,为了保护环境,这些废液必须经处理后才能排放。某化学实验室产生的废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
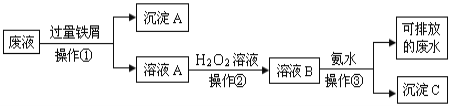
(1)操作①的名称是_______。
(2)沉淀A中含有的金属单质有_______。
(3)操作②中观察到的实验现象是_______。
(4)操作③中发生反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物环丙叉环丙烷,由于其特殊的电导结构一直受到理论化学家的注意,其结构如图所示。有关它的说法中错误的是( )
![]()
A. 其二氯代物有4种 B. 它所有的原子均在同一平面上
C. 其分子式为C6H8 D. 它不可能是环丙烷的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铝箔包裹0.1mol金属钠,用针在铝箔上扎一些小孔,用镊子夹住,放入水中,待完全反应后,收集到的气体在标准状况下的体积为
A. 等于1.12L B. 等于0.56L C. 大于1.12L D. 小于1.12L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com