
【题目】某城市主要空气污染物为![]() 、
、![]() 、
、![]() 科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:
科学实验小组为检测空气样本成分,用蒸馏水处理制成待测液,设计实验及所得实验现象如下:

下列判断不正确的是
A.上述实验中可用![]() 代替
代替![]() ,以证明待测试样中含
,以证明待测试样中含![]()
B.由实验![]() 可知待测试样中含有
可知待测试样中含有![]() 和
和![]()
C.焰色反应表明待测试样中含Na元素和K元素
D.该城市的污染来源主要是燃煤和机动车尾气排放
【答案】A
【解析】
A. 酸性条件下Ba(NO3)2溶液中的硝酸根离子能将亚硫酸根离子氧化,从而干扰硫酸根离子的检验,故不能用Ba(NO3)2代替BaCl2来证明待测试样中含SO42-,选项A不正确;
B、实验②和强碱共热反应产生能使湿润红色石蕊试纸变蓝的气体,证明含有铵根离子,实验⑤溶液中加入几滴硫酸,再加入金属铜,试管口产生红棕色气体,证明原溶液含有硝酸根离子,选项B正确;
C、实验①焰色反应为黄色,所以含有钠元素,实验⑥透过蓝色钴玻璃观察焰色反应呈现紫色,证明含钾元素,故焰色反应表明待测试样中含Na元素和K元素,选项C正确;
D、根据判断可知,该城市的污染物含有硫和氮的氧化物,故主要来源是是燃煤和机动车尾气排放,选项D正确。
答案选A。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1 mol·L1的醋酸溶液和氨水各20 mL,分别用0.1 mol·L1 氢氧化钠溶液和0.1 mol·L1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
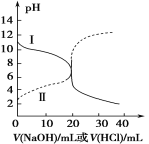
A.曲线I,滴加10 mL溶液时:c(NH4+)+c(H+)=c(OH-)+c(NH3·H2O)
B.曲线I,滴加20 mL溶液时:两溶液恰好完全反应,此时溶液的pH<7
C.曲线II,滴加溶液体积在10~20 mL之间时存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II,滴加30 mL溶液时:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下进行合成氨的反应N2(g)+3H2(g) ![]() 2NH3(l),根据下列在相同时间内测定的结果判断生成氨的速率最快的是( )
2NH3(l),根据下列在相同时间内测定的结果判断生成氨的速率最快的是( )
A.v(H2)=0.1mol/(L·min)B.v(N2)=0.1mol/(L·min)
C.v(N2)=0.2mol/(L·min)D.v(NH3)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是![]()
选项 | 实验 | 现象 | 结论 |
A | 向2mL | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B | 往 | 产生白色胶状沉淀 | 酸性: |
C | 常温下将铝片加入浓硝酸中 | 无明显现象 | 铝与浓硝酸不反应 |
D | 将 | 紫色溶液褪色 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
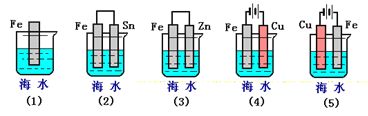
A. (5)(2)(1)(3)(4) B. (2)(5)(3)(4)(1)
C. (5)(3)(4)(1)(2) D. (1)(5)(3)(4)(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类生活中最常见、应用最广泛的金属,钢铁在空气中很容易被腐蚀。
(1)炒过菜的铁锅未及时洗净(残液中含有 NaCl),不久便会因腐蚀而出现褐色锈斑。铁锅锈蚀的电极反应式为:负极___________________________,正极___________________________。
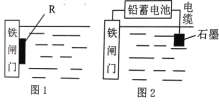
(2)为了降低某水库的铁闸门的腐蚀速率,可以采用图 1 所示的方案,其中焊接在铁闸门上的固体材料 R 可以采用 _______________ (填序号)。
A、铜 B、锌 C、钠 D、石墨
(3)图 2 所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在铅蓄电池的_______极上(填“正”或“负”)。
(4)常温下以铅蓄电池为电源,用石墨作电极电解 1L 0.1mol/L NaCl溶液,电解一段时间后,测得溶液的 pH 为 13,则铅蓄电池中转移电子的物质的量为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将等浓度的NaOH溶液分别滴加到等pH、等体积的HA,HB两种弱酸溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述错误的是![]()
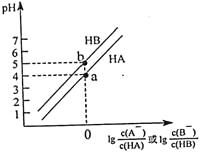
A.a、b两点,溶液中水的电离程度:![]()
B.电离平衡常数:![]()
C.a点时,![]()
D.向HA溶液中滴加NaOH溶液至中性时:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com