
| A. | 高纯度的硅单质用于制作光导纤维 | |
| B. | Al2O3熔点很高,可用作耐火材料 | |
| C. | SO2可以用来漂白面条 | |
| D. | N2与O2在放电条件下直接化合生成NO2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
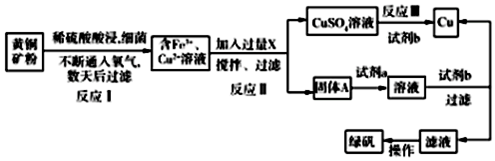
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种溶液pH的大小顺序是③>②>① | |
| B. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| C. | 若分别加入25 mL 0.1 mol/L盐酸后,pH最大的是① | |
| D. | 3种溶液中,由水产生的c(H+)大小顺序是①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

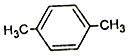 D.
D.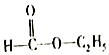
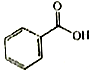 F.
F. 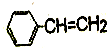 G.
G.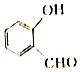
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2 | |
| B. | 铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中 | |
| C. | 化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色 | |
| D. | 密度为1.1 g•cm-3与密度为1.2 g•cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g•cm-3与1.2 g•cm-3之间; Na-K合金的熔点应介于Na和K熔点之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu
(1)①NH3②SO3③Cl2④BaSO4⑤酒精 ⑥CH3COONH4⑦HClO⑧Cu查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com