
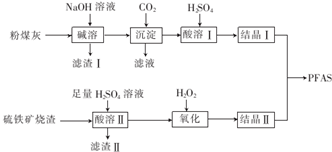
分析 粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3,再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体.硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+H2SO4=FeSO4+H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS.
(1)加入NaOH溶液使Al2O3溶解生成偏铝酸钠和水,氧化铁、氧化亚铁和氢氧化钠不反应,为充分利用Fe元素,将滤渣与硫铁矿烧渣一起用硫酸溶解;
(2)通入二氧化碳后得到氢氧化铝沉淀,滤液中主要含有碳酸氢钠;氢氧化铝用硫酸溶解得到酸溶Ⅰ;
(3)H2O2氧化Fe2+时,温度不能过高,其原因是温度过高,H2O2会分解;
(4)PFAS溶于水产生Fe3+、Al3+,Fe3+、Al3+水解生成氢氧化铝胶体和氢氧化铁胶体,具有吸附性能净水;
因为Fe3+、Al3+水解均呈酸性,所以产品PFAS中硫酸残留过多,会抑制Al3+、Fe3+水解,降低絮凝效果,并且酸度过大影响水质
(5)根据电荷守恒可知a、b、m、n间的关系;
根据消耗的盐酸计算n(OH-),根据与BaCl2反应沉淀的沉淀的质量求出n(SO42-),根据与碘离子反应的关系求出n(Fe3+),根据电荷守恒计算n(Al3+),再根据总质量求出水的质量及物质的量,根据物质的量之比确定化学式.
解答 解:粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3,再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体.硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+H2SO4=FeSO4+H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS.
(1)氧化铝为两性氧化物,“碱溶”时Al2O3发生反应的滤渣化学方程式为:Al2O3+2OH-=2AlO2-+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,滤渣Ⅰ的主要成分为Fe2O3、FeO,为充分利用Fe元素,将滤渣I与硫铁矿烧渣一起用硫酸溶解加以利用,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Fe2O3、FeO;与硫铁矿烧渣一起用硫酸溶解加以利用;
(2)通入二氧化碳后得到氢氧化铝沉淀,滤液中主要含有NaHCO3;氢氧化铝用硫酸溶解得到酸溶Ⅰ的溶质为Al2(SO4)3,
故答案为:NaHCO3;Al2(SO4)3;
(3)H2O2将Fe2+为Fe3+,“氧化”时应控制温度不超过57℃,其原因是温度过高,H2O2会分解,
故答案为:温度过高,H2O2会分解;
(4)聚合硫酸铝铁溶于电离出Fe3+、Al3+,Fe3+、Al3+水解生成氢氧化铝胶体和氢氧化铁胶体,具有吸附性,吸附悬浮物质而净水;
因为Fe3+、Al3+水解均呈酸性,所以产品PFAS中硫酸残留过多,会抑制Al3+、Fe3+水解,降低絮凝效果,并且酸度过大影响水质,
故答案为:聚合硫酸铝铁溶于电离出Fe3+、Al3+,Fe3+、Al3+水解生成氢氧化铝胶体和氢氧化铁胶体,具有吸附性;会抑制Al3+、Fe3+水解,降低絮凝效果,并且酸度过大影响水质;
(5)根据电荷守恒,可知3a+3b=m+2n,
n(OH-)=2n(H2SO4)=0.15L×0.100 mol•L-1×2=0.03mol,
n(SO42-)=n(BaSO4)-n(H2SO4)=$\frac{10.485g}{233g/mol}$-0.15L×0.100 mol•L-1=0.03mol,
已知:I2+2Na2S2O3=2NaI+Na2S4O6,2Fe3++2I-=2Fe2++I2,则2Fe3+~I2~2Na2S2O3,
n(Fe3+)=n(Na2S2O3)=0.02L×0.500 mol•L-1=0.01mol,
在AlaFeb(OH)m(SO4)n中离子所带电荷守恒,
则n(Al3+)=$\frac{1}{3}$×(0.03mol+0.03mol×2-0.01mol×3)=0.02mol
8.810g样品中水的质量:m(H2O)=8.810g-0.02mol×27g•mol-1-0.01mol×56 g•mol-1-0.03mol×17 g•mol-1-0.03mol×96 g•mol-1=4.32 g,
则n(H2O)=$\frac{4.32g}{18g/mol}$=0.24mol,
所以n(Al3+):n(Fe3+):n(OH-):n(SO42-):n(H2O)=2:1:3:3:24
则硫酸铝铁的化学式为:Al2Fe(OH)3(SO4)3•24H2O;
故答案为:3a+3b=m+2n;Al2Fe(OH)3(SO4)3•24H2O.
点评 本题考查物质制备工艺流程、物质的组成的测定等,题目难度中等,侧重于考查学生的分析能力和计算能力,是对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H6 | B. | CH3CHO | C. | CH3COOH | D. | CH2=CH-COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
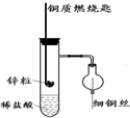 如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.
如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一电离能 | 电负性 | 稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
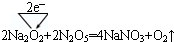 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| B. | S$→_{催化剂/△}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| D. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com