
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 欲配制1.00 L 1.00mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0g金属钠 |
分析 A、从氯化钠是离子混合物分析判断;
B、依据浓度的含义分析,固体溶于水中体积已不是1L;
C、依据钠离子是原子失去最外层电子形成,离子最外层电子数是8分析;
D、根据电解熔融氯化钠的化学方程式计算判断.
解答 解:A、氯化钠是离子化合物,在常温下无氯化钠分子存在,故A错误;
B、58.5 g NaCl物质的量为1mol,但溶于1.00 L水中后,溶液的体积大于1L,所以氯化钠的物质的量浓度小于1mol/L,故B错误;
C、Na+的最外层电子电子为8,所以1.00 mol NaCl中,所有Na+的最外层电子总数为8mol,即8×6.02×1023,故C正确;
D、电解58.5g熔融的NaCl发生的反应为2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑,58.5g氯化钠物质的量为1mol,所以生成钠1mol,
质量为23g,生成氯气为0.5mol,标准状况下的体积为11.2L,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,主要是化合物的类别判断,离子结构的形成,溶液配制溶液体积的变化,电解计算,关键是溶液体积的判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>PH3>SiH4 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ•mol-1 | |
| B. | 2Ag(s)+Cl2(g)═2AgCl(s)△H=-127 kJ•mol-1 | |
| C. | 2HgO(s)═2Hg(l)+O2(g)△H=+91 kJ•mol-1 | |
| D. | 2H2O2(l)═O2(g)+2H2O(l)△H=-98 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸中放出氢气量最多 | B. | 反应速率H2SO4>HCl>CH3COOH | ||
| C. | 放出氢气量:HCl>CH3COOH | D. | 放出氢气量:HCl=CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳是温室气体,但不是大气污染物 | |
| B. | 农村常用明矾净水,是利用了胶体的性质 | |
| C. | 食品添加剂对人体无害,可大量食用 | |
| D. | 氯化钠是常用的防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 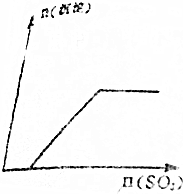 | B. | 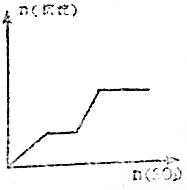 | ||
| C. | 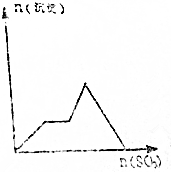 | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com