
(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
元素X基态原子的p电子比s电子少1个。元素Y基态原子的2p电子是2s电子的2倍。元素Z的一种单质为自然界硬度最大的物质。元素M位于第四周期,其基态原子失去3个电子后3d轨道半满。
(1)X、Y、Z的基态原子,第一电离能由大到小的顺序是 。
(2)X的氢化物易于液化,其原因是 。
(3)X与M形成的一种化合物晶胞结构如图所示。
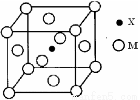
①每个晶胞中M离子的数目为 ;
②该化合物的化学式为 。
(4)Y可形成单质Y3
①Y3分子的空间构型为 (用文字描述)。
②写出一种与Y3互为等电子体的分子的化学式: 。
(5)Y、Z的化合物ZY可与M的单质生成配合物M(ZY)5,该配合物中σ键与π键的个数比为 。
(1)N>O>C (2分)(2)氨分子间形成氢键 (2分)(3)①4 ②Fe4N (各1分)
(4)①V型(或折线型) (2分)②SO2 (2分)(5)1∶1 (2分)
【解析】
试题分析:元素X基态原子的p电子比s电子少1个,则电子排布为1s22s22p3,为N元素;元素Y基态原子的2p电子是2s电子的2倍,则2p轨道排布4个电子,为O元素;元素Z的一种单质为自然界硬度最大的物质,则元素Z为C元素;元素M位于第四周期,其基态原子失去3个电子后3d轨道半满,则M基态原子3 d轨道排布6个电子,为Fe元素。
(1)N元素2p轨道排布3个电子,为稳定状态,所以第一电离能由大到小顺序为:N>O>C
(2)N原子半径小,电负性大,氨分子间容易形成氢键,所以NH3易液化。
(3)①M位于8个顶点和6个面心,根据均摊法,每个晶胞含Fe:8×1/8+6×1/2=4。
②N原子位于晶胞中心,含有1个N原子,所以化学式为:Fe4N
(4)①O3中心O原子形成了2个O-O键,含有2对孤对电子,为sp3杂化,所以空间构型为V型(或折线型)。
②含有原子数和价电子数相等的微粒为等电子体,与O3互为等电子体的分子的化学式为SO2
(5)配合物M(ZY)5,为Fe(CO)5,含有5个σ键和5个π键,所以该配合物中σ键与π键的个数比为1:1。
考点:本题考查元素的推断、第一电离能比较、氢键、晶胞的计算、空间构型、等电子体。


科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:填空题
(14分)常温下,某水溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子有H2O、H2B。根据题意回答下列问题:
(1)写出酸H2B的电离方程式 ﹑ 。
(2)常温下,已知0.1 mol·L-1二元酸H2B溶液中c(OH-) / c(H+)=1×10-6。
①常温下,0.1 mol·L-1H2B溶液的pH= ;
②写出该酸(H2B)与少量NaOH溶液反应的离子方程式: ;
(3)常温下,将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液充分混合(溶液体积变化忽略不计),所得溶液的pH= 。
(4)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw= 。该温度下(t℃),0.1 mol·L-1HCl溶液的pH= ;
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观象冰。1体积“可燃冰”可储藏100~200体积的天然气。下面关于“可燃冰”的叙述不正确的是
A.“可燃冰”有可能成为人类未来的重要能源 B.“可燃冰”是一种比较洁净的能源
C.“可燃冰”提供了水可能变成油的例证 D.“可燃冰”的主要可燃成分是甲烷
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三第三次调研测试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B.合成氨的反应是放热反应,则采用低温条件可以提高氨的生成速率
C.常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应
D.NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三第三次调研测试化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A.钠具有很强的还原性,可用钠与TiCl4溶液反应制取钛
B.铝表面易形成致密的氧化膜,可用铝制贮罐盛装稀硝酸
C.酒精是良好的有机溶剂,可洗去皮肤表面沾有的苯酚
D.硫酸铜能与氯化钡反应,可用于给误食氯化钡的患者洗胃
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:填空题
(12分)纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:

请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式 。
(2)将酸浸的尾气循环利用,加入的X气体可以是 。
(3)流程中加入ZnO调pH的目的是 。
(4)滤渣2中的成分是 。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol·L-1,则溶液中S2—浓度大于 mol·L一1,才生成ZnS沉淀。
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:选择题
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图),与电解质和正极材料(石墨)构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2  4Li+2SOCl2。下列说法正确的是
4Li+2SOCl2。下列说法正确的是
A.电池的电解液可为LiCl水溶液
B.该电池放电时,负极发生还原反应
C.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2
D.放电时电子从负极经外电路流向正极,再从正极经
电解质流向负极
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省海门市第一学期期末教学质量调研高一化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向水中通入氯气:Cl2+H2O===2H++Cl-+ClO-
B.碳酸钠溶液中通入二氧化碳:CO32-+CO2+H2O ===2HCO3-
C.实验室制备氯气:MnO2+4HCl(浓)=== 2Mn2++2H2O+2Cl2↑
D.稀硫酸与氢氧化钡溶液反应:H++ SO42-+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向盐酸中加入适量氨水:H++OH-=H2O
B.铁与足量稀HNO3反应:3Fe+ 8H++2NO3-=3 Fe 2++2NO↑+4H2O
C.氢氧化铜溶于硝酸:2H++Cu(OH)2=Cu2+ +2H2O
D.铜与浓HNO3反应:Cu+4H++2NO3- = Cu2+ +2H2O+2NO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com