
【题目】某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气和MnCl2等.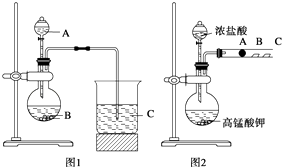
(1)甲同学实验中选用的物质化学式为:A , B , C;
(2)C处反应的离子方程式为;
(3)写出乙同学的实验中圆底烧瓶中发生反应的化学方程式;
(4)A处反应的离子方程式为;
(5)B处的实验现象为 .
【答案】
(1)HNO3;CaCO3/BaCO3/Na2CO3;Na2SiO3/K2SiO3
(2)SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣(CO2不足)或SiO32﹣+2CO2+2H2O═H2SiO3↓+2HCO3﹣(CO2过量)
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
(4)Cl2+2Br﹣=Br2+2Cl﹣
(5)试纸变蓝
【解析】解:(1.)根据题干信息:甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究,硝酸的酸性强于碳酸,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,所以A为稀硝酸,B为碳酸钙或碳酸钡或碳酸钠,C为硅酸钠或硅酸钾溶液,化学式分别为:HNO3、CaCO3/BaCO3/Na2CO3溶液、Na2SiO3/K2SiO3 , 所以答案是:HNO3;CaCO3/BaCO3/Na2CO3;Na2SiO3/K2SiO3;
(2.)图1烧杯中为二氧化碳与硅酸钠反应,其反应的离子方程式为:SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣(CO2不足),或是SiO32﹣+2CO2+2H2O═H2SiO3↓+2HCO3﹣(CO2过量),所以答案是:SiO32﹣+CO2+H2O═H2SiO3↓+CO32﹣(CO2不足)或SiO32﹣+2CO2+2H2O═H2SiO3↓+2HCO3﹣(CO2过量);
(3.)乙同学的实验中圆底烧瓶中浓盐酸和酸性高锰酸钾溶液反应生成氯气,反应方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,所以答案是:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;
(4.)单质的氧化性Cl2>Br2 , 则A处氯气通过沾有NaBr溶液的棉花,发生置换反应生成溴,反应的离子方程式为Cl2+2Br﹣=Br2+2Cl﹣ , 所以答案是:Cl2+2Br﹣=Br2+2Cl﹣;(5)通过B处的气体主要是氯气,氯气能氧化碘离子,Cl2+2I﹣=2Cl﹣+I2 , 碘与淀粉作用显示蓝色,所以B处的现象变蓝,所以答案是:试纸变蓝.


科目:高中化学 来源: 题型:
【题目】某学生利用如图所示装置对电解质溶液导电性进行实验探究.下列说法中正确的是( ) 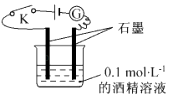
A.闭合开关K后,电流计 ![]() 指针不发生偏转,证明酒精溶液是非电解质
指针不发生偏转,证明酒精溶液是非电解质
B.闭合开关,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质
C.取用0.1 molL﹣1的蔗糖溶液替换酒精溶液,电流计的示数相同,说明蔗糖是非电解质
D.闭合开关,往烧杯中加NaCl固体,虽然固体溶解,由于不反应,故电流计指针不发生偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙在工农业生产中有广泛的用途。
(1)过氧化钙制备方法很多。
①制备方法一:H2O2溶液与过量的Ca(OH)2悬浊液反应可制备CaO2·8H2O,其化学方程式为:_________。
②制备方法二:利用反应Ca(s)+O2 ![]() CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
CaO2(s),在纯氧条件下制取CaO2,实验室模拟装置示意图如下:
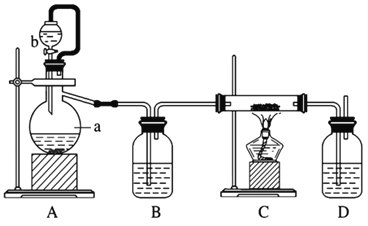
请回答下列问题:
装置A中反应的化学方程式为_________,仪器a的名称为 ________。装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是____________。
(2)水中溶氧量(DO)是衡量水体白净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1。测定原理为:
①碱性条件下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH-=2MnO(OH)2↓;
②酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③用Na2S2O2标准溶液滴定生成的I2:2S2O32-+I2=S4O62-+2I-。
水产运输中常向水中加一定量CaO2·8H2O作供氧剂,取此水样100.0 mL,按上述方法测定水中溶氧量,消耗0.01000 mol/L Na2S2O2标准溶液13.50 mL。
滴定过程中使用的指示剂是________;该水样中的溶解氧量(DO)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
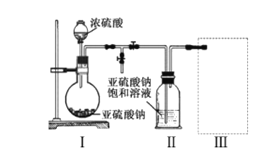
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。 装置II中有Na2S2O5晶体析出,发生的反应为: Na2SO3+SO2=Na2S2O5
(1)装置1中产生气体的化学方程式为_____________________
(2)要从装置II 中获得已析出的晶体,可采取的分离方法是_____________________
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___(填序号)。

实验二 焦亚硫酸钠的性质
已知: Na2S2O5 易被氧化,溶于水即生成NaHSO3
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________________。
(5)设计实验证明NaHSO3溶液中HSO3-的电离程度大于水解程度___________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。则定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,滴定终点的现象是______________________________。滴定时消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________kg/L。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果____________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质必须隔绝空气保存的是
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3 ⑥NaCl
A. ①② B. ②③④⑤ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。

下列装置分别是产品的合成装置和精制装置示意图:

合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。回答下列问题:
(1)在合成装置中,甲装置的名称是__________________。
(2)三颈烧瓶的容量为____________(填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗具有特殊的结构,主要目的是__________。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是_________。然后加入精制食盐使之变成饱和溶液,其目的是________。再将混合液倒入分液漏斗中,分离得到有机层。
(5)有机层先加无水MgSO4,用如上右图对粗产品进行精制,加入无水MgSO4的作用是_____。检验精制后的坏己酮是否纯净,可使用的试剂为________________。
A.重铬酸钾溶液B.金属钠C.酚酞溶液 D.新制的氢氧化铜悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.稀的食盐水能杀死H7N9禽流感病毒
B.煤经过分馏和干馏两个物理变化,可变为清洁能源
C.电镀厂的废水直接用来灌溉农田,可提高水的利用率
D.用CO2合成聚碳酸酯可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油炼制过程中产生的大量H2S废气的处理设计方案如下图所示,下列说法不合理的是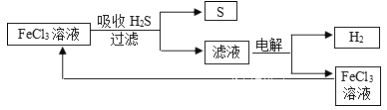
A. 吸收H2S的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+
B. 电解过程中的阳极可发生的竞争反应主要为:2Cl--2e-=Cl2↑
C. 该工艺流程设计上处理废气H2S的同时也获得产品H2和S
D. 实验室可用点燃充分燃烧的方法消除H2S污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com