
对于0.1 mol·L-1 NH4Cl溶液,下列说法或列式正确的是
A.升高温度,溶液pH升高 B.通入少量HCl,c(NH4+)和c(Cl-)均增大
C.c(NH4+) + c(OH-)=c(Cl-)+ c(H+) D.c(Cl-) > c(H+) > c(NH4+) > c(OH-)
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称取的4.3 g烧碱样品配制成250 mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还必须用到的仪器有 。
(2)取待测液10.00 mL,用 滴定管量取,并置于锥形瓶中。
(3)向锥形瓶中滴加几滴指示剂,用0.200 mol·L-1标准盐酸滴定待测烧碱溶液。不适宜选用的指示剂为(选填序号):________。①石蕊试液 ②无色酚酞 ③甲基橙试液
(4)根据两次滴定获得的实验数据如下表,得出烧碱的纯度为 。
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是(选填字母) 。
A.酸式滴定管未用盐酸标准溶液润洗就直接注入盐酸标准溶液
B.锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C.装有盐酸标准溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取HCl溶液体积时,开始仰视读数,滴定结束时俯视读数
E.若刚见到指示剂局部的颜色有变化就停止滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) + 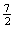 O2(g)=2CO2(g) +3H2O(l) △H =-1560kJ·mol-1
O2(g)=2CO2(g) +3H2O(l) △H =-1560kJ·mol-1
B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g) △H =-1560kJ·mol-1
C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l) △H =+3120 kJ·mol-1
D.C2H6(g) + O2(g)=2CO2(g) +3H2O(l) △H =-52.0kJ·mol-1
O2(g)=2CO2(g) +3H2O(l) △H =-52.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【选做题】本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。
若多做,则按A小题评分。
A.[物质结构与性质]
利用反应:Cu2Cl2 +C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔。
(1)基态时亚铜离子核外电子排布式为 ▲ 。
(2)NH3中氮原子的杂化方式为 ▲ ;NH4+空间构型为 ▲ (用文字描述)。
(3)乙炔分子中σ键与π键数目之比为 ▲ ,与C22-互为等电子体的分子有 ▲ (写化学式,举一例)。
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为 ▲ 。
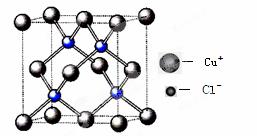
(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有 ▲ (写化学式)。
B.[实验化学]
已二酸是一种重要的化工中间体,可通过氧化环已醇得到。
反应原理为:

实验步骤:
步骤1.在图①所示装置的三颈瓶中加入6gKMnO4和50mL0.3mol/LNaOH溶 液,搅拌加热使之溶解。
液,搅拌加热使之溶解。
步骤2.在继续搅拌下用滴管滴加21mL环已醇,控制滴加速度,维持反应温度43~47℃。滴加完毕后, 在沸水浴中将混合物加热几分钟。
在沸水浴中将混合物加热几分钟。
步骤3.用图②所示装置趁热抽滤,二氧化锰滤渣用水洗2~3次
步骤4.滤液用小火加热蒸发浓缩至原来体积的一半,冷却后再用浓盐酸酸化至pH为2~4,冷却析出粗产品
步骤5.将粗产品用水进行重结晶提纯,然后在烘箱中烘干。

(1)写出实验仪器名称:a ▲ ; b ▲ 。
(2)步骤2在沸水浴中将混合物加热几分钟的目的是: ▲ 。
(3)步骤3趁热抽滤的目的是: ▲ ;如 何证明步骤3滤渣已洗涤干净: ▲ 。
何证明步骤3滤渣已洗涤干净: ▲ 。
(4)步骤4用盐酸酸化的目的是: ▲ 。
(5)确定最后产品成分为已二酸,还需做的实验或仪器分析有 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下, 恒容密闭容器中, 充入一定量的NO和O2, 发生反应O2(g)+2NO(g) 2 NO2(g) , 反应已达到平衡的标志是
2 NO2(g) , 反应已达到平衡的标志是
A.混合气体的颜色不再变化 B.O2 、NO、NO2三种物质的反应速率之比为1∶2 ∶2
C.反应混合物中各组分物质的浓度相等 D.混合气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为一原电池的结构示意图,下列说法中,错误的是
A.Cu电极为正极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,0.1mol·L-1的某一元碱MOH溶液pH = 13,将它和某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是( )
A.HA溶液的pH一定为1 B.盐MA可能水解
C.HA物质的量浓度一定为0.1mol·L-1 D.混合后溶液中,c(M+)一定等于c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取
B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物。(反应条件图中已省略)
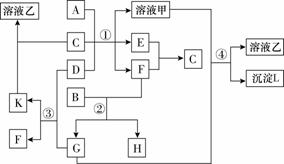
(1)A、B、C、D代表的物质分别为______、______、______、______(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是
________________________________________________________________________
________________________________________________________________________;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是 CO2 、 CO (填化学式);
(4)反应③产物中K的化学式为 Na2CO3 ;
(5)反应④的离子方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com