
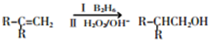
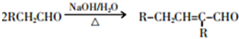
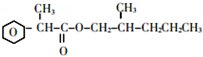 .
.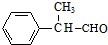 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$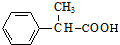 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.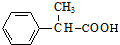 +CH3CH2CH2CH2CH(CH3)OH$→_{△}^{浓硫酸}$
+CH3CH2CH2CH2CH(CH3)OH$→_{△}^{浓硫酸}$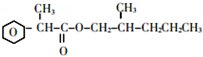 +H2O.F→G的化学方程式2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O.
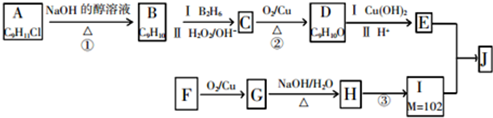
+H2O.F→G的化学方程式2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O.分析 A的分子式为C9H11Cl,苯环上只有一个侧链,且核磁共振氢谱表明其中有四种化学环境的氢,则A为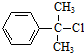 ,A发生消去反应生成B为
,A发生消去反应生成B为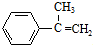 ,B发生信息②中的反应生成C为
,B发生信息②中的反应生成C为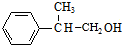 ,C发生催化氧化生成D为
,C发生催化氧化生成D为 ,D与新制氢氧化铜发生氧化反应,酸化得到E为
,D与新制氢氧化铜发生氧化反应,酸化得到E为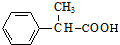 .由(1)中饱和一元醇F中氧的质量分数约为26.7%,F的相对分子质量为$\frac{16}{26.7%}$=60,设其分子式为CnH2n+2O,则14n+2+16=60,解得n=3,结构分析显示F只有一个甲基,
.由(1)中饱和一元醇F中氧的质量分数约为26.7%,F的相对分子质量为$\frac{16}{26.7%}$=60,设其分子式为CnH2n+2O,则14n+2+16=60,解得n=3,结构分析显示F只有一个甲基,
故F为CH3CH2CH2OH,F发生催化氧化生成G为CH3CH2CHO,G发生信息③中的反应生成H为CH3CH2CH=C(CH3)CHO,I的相对分子质量为102,H相对分子质量为58+58-18=98,则H与氢气发生加成反应生成I为CH3CH2CH2CH2CH(CH3)OH,E与I发生酯化反应生成J为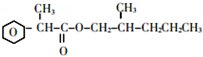 ,据此解答.
,据此解答.
解答 解:A的分子式为C9H11Cl,苯环上只有一个侧链,且核磁共振氢谱表明其中有四种化学环境的氢,则A为 ,A发生消去反应生成B为
,A发生消去反应生成B为 ,B发生信息②中的反应生成C为
,B发生信息②中的反应生成C为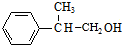 ,C发生催化氧化生成D为
,C发生催化氧化生成D为 ,D与新制氢氧化铜发生氧化反应,酸化得到E为
,D与新制氢氧化铜发生氧化反应,酸化得到E为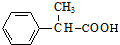 .由(1)中饱和一元醇F中氧的质量分数约为26.7%,F的相对分子质量为$\frac{16}{26.7%}$=60,设其分子式为CnH2n+2O,则14n+2+16=60,解得n=3,结构分析显示F只有一个甲基,故F为CH3CH2CH2OH,F发生催化氧化生成G为CH3CH2CHO,G发生信息③中的反应生成H为CH3CH2CH=C(CH3)CHO,I的相对分子质量为102,H相对分子质量为58+58-18=98,则H与氢气发生加成反应生成I为CH3CH2CH2CH2CH(CH3)OH,E与I发生酯化反应生成J为
.由(1)中饱和一元醇F中氧的质量分数约为26.7%,F的相对分子质量为$\frac{16}{26.7%}$=60,设其分子式为CnH2n+2O,则14n+2+16=60,解得n=3,结构分析显示F只有一个甲基,故F为CH3CH2CH2OH,F发生催化氧化生成G为CH3CH2CHO,G发生信息③中的反应生成H为CH3CH2CH=C(CH3)CHO,I的相对分子质量为102,H相对分子质量为58+58-18=98,则H与氢气发生加成反应生成I为CH3CH2CH2CH2CH(CH3)OH,E与I发生酯化反应生成J为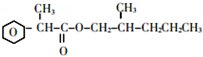 .
.
(1)由上述分析可知,F为CH3CH2CH2OH,名称是:1-丙醇,故答案为:1-丙醇;
(2)上述合成路线中属于消去反应的是:①,J的结构简式为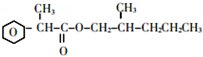 ,
,
故答案为:①;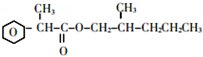 ;
;
(3)D与Cu(OH)2发生反应的化学方程式为: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$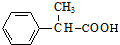 +Cu2O↓+2H2O,
+Cu2O↓+2H2O,
故答案为: +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$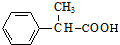 +Cu2O↓+2H2O;
+Cu2O↓+2H2O;
(4)CH3CH2CH=C(CH3)CHO,所含官能团的名称为:碳碳双键、醛基,若一次取样,检验H中所含官能团,应先用银氨溶液检验醛基,因为醛基也能被溴水氧化,用银氨溶液检验完醛基后溶液显碱性,溴水与碱性溶液反应,因此必须加入酸中和使溶液呈酸性后再加溴水检验碳碳双键,按使用顺序写出所用试剂:银氨溶液、稀盐酸、溴水,
故答案为:碳碳双键、醛基;银氨溶液、稀盐酸、溴水;
(5)E+I→J的化学方程式为: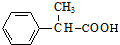 +CH3CH2CH2CH2CH(CH3)OH$→_{△}^{浓硫酸}$
+CH3CH2CH2CH2CH(CH3)OH$→_{△}^{浓硫酸}$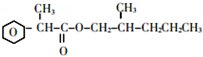 +H2O,
+H2O,
F→G的化学方程式为:2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O,
故答案为: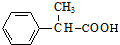 +CH3CH2CH2CH2CH(CH3)OH$→_{△}^{浓硫酸}$
+CH3CH2CH2CH2CH(CH3)OH$→_{△}^{浓硫酸}$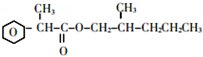 +H2O;2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O;
+H2O;2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O;
(6)E(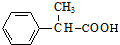 )的同分异构体能同时满足如下条件:a.苯环上只有一个取代基,b.能发生水解反应,含有酯基,侧链为-OOCCH2CH3,-CH2OOCCH3,-CH2CH2OOCH,-CH(CH3)OOCH,-COOCH2CH3,-CH2COOCH3,共有6种,
)的同分异构体能同时满足如下条件:a.苯环上只有一个取代基,b.能发生水解反应,含有酯基,侧链为-OOCCH2CH3,-CH2OOCCH3,-CH2CH2OOCH,-CH(CH3)OOCH,-COOCH2CH3,-CH2COOCH3,共有6种,
故答案为:6.
点评 本题考查有机物的推断,充分利用有机物的分子式、A的结构特点与反应条件进行推断,题目涉及有机方程式的书写、官能团的结构、多官能团的检验、反应类型的判断、同分异构体的种数判断等,(4)中要注意官能团检验的干扰问题,难度中等.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 标准状况下,0.1mol氯仿的体积为2.24L | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3SO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸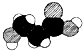 | |
| D. | 化合物 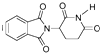 在酸性条件下水解,所得溶液加碱后加热有NH3生成 在酸性条件下水解,所得溶液加碱后加热有NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅石常用作光导纤维、光学仪器的原料 | |
| B. | Al(OH)3可作阻燃剂,因此可以用于灭火 | |
| C. | 酚醛树脂可作木材粘合剂、制作食用器具 | |
| D. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的结构式:H-Cl-O | |
| B. | NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | 羟基的电子式: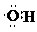 | |
| D. | 异丙醇的结构简式:CH3CH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 TiO2•XH2O↓+4HCl
TiO2•XH2O↓+4HCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1molH-H键需要的能量小于断开1molCl-Cl键需要的能量 | |
| B. | 反应在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能小于反应②的活化能 | |
| D. | 已知反应②的△H>0,则反应③的△H一定小于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中MnO2和H2SO4都是氧化剂 | |
| B. | 反应①中每析出12.8g S沉淀,转移0.8mol电子 | |
| C. | 金属锌也可用热还原法制备 | |
| D. | 硫酸在生产种可循环使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com