
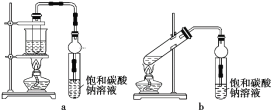
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是________;
(2)饱和Na2CO3溶液的作用是________、_______、________。
(3)写出反应原理:________。
(4)若用b装置制备乙酸乙酯,其缺点有_______、________。由b装置制得的乙酸乙酯粗产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是_______,分离乙酸乙酯与该杂质的方法是______。
【答案】增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率 浓硫酸能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率 中和乙酸 溶解乙醇 减少乙酸乙酯在水中的溶解 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 原料损失较大 易发生副反应 乙醚 蒸馏
CH3COOCH2CH3+H2O 原料损失较大 易发生副反应 乙醚 蒸馏
【解析】
根据CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O反应原理和影响化学反应平衡移动的原理进行分析,根据CH3COOH、CH3CH2OH、CH3COOCH2CH3三种物质的性质解答饱和Na2CO3溶液的作用,根据实验装置的特点进行优缺点分析。
CH3COOCH2CH3+H2O反应原理和影响化学反应平衡移动的原理进行分析,根据CH3COOH、CH3CH2OH、CH3COOCH2CH3三种物质的性质解答饱和Na2CO3溶液的作用,根据实验装置的特点进行优缺点分析。
(1)由于是可逆反应,因此加入过量的乙醇增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率。由于浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率,因此实际用量多于此量;由于浓H2SO4具有强氧化性和脱水性,会使有机物碳化,所以浓硫酸用量又不能过多,故答案为:增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率;浓硫酸能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;
(2)由于生成的乙酸乙酯中含有乙醇和乙酸,所以饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解,故答案为:中和乙酸;溶解乙醇;减少乙酸乙酯在水中的溶解;
(3)乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,其反应方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)根据b装置可知由于不是水浴加热温度不易控制,因此制备乙酸乙酯的缺点是:原料损失较大、易发生副反应,由于乙醇溶液发生分子间脱水生成乙醚,所以b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,乙醚和乙酸乙酯的沸点相差大,所以分离乙酸乙酯与乙醚的方法是蒸馏,故答案为:原料损失较大;易发生副反应;乙醚;蒸馏。


科目:高中化学 来源: 题型:
【题目】某科研团队研究发现硼氢化钠(NaBH4)在催化剂Ru表面与水反应可生成H2,其反应机理如图所示:
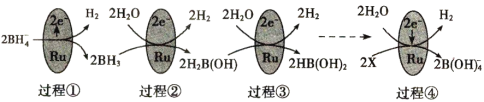
根据以上信息判断,下列叙述错误的是
A.过程①至过程④中硼元素的化合价不变
B.X是H3BO3,H3BO3和BH3两分子中H的化合价相等
C.过程③和过程④各产生1molH2时转移的电子数不相等
D.0.25molNaBH4的还原能力与标准状况下22.4LH2的还原能力相当(还原能力即生成H+失去电子的量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Cl2通入水中:Cl2 + H2O = 2H+ + Cl- + ClO-
B.FeCl3溶液腐蚀铜箔制印刷线路板:Fe3+ + Cu = Fe2+ + Cu2+
C.H2SO4溶液和Ba(OH)2溶液混合:H+ + SO42- + Ba2+ + OH-= BaSO4↓ + H2O
D.澄清石灰水中通入过量二氧化碳:OH- + CO2 = HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的HA和MOH溶液,加水稀释至原来体积的n倍。稀释过程中,两溶液的pH变化如图所示。下列叙述正确的是( )

A. HA为弱酸,MOH为强碱
B. 水的电离程度:X>Y=Z
C. 若升高温度,Y、Z点对应溶液的pH均减小
D. 将Y点与Z点对应溶液以体积比为1:10混合,所得溶液中:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知PbI2的Ksp=7.0×10-9,将7.5×10-3 mol/L的KI与一定浓度的Pb(NO3)2溶液按2∶1体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为
A.8.4×10-4mol/LB.5.6×10-4mol/L
C.4.2×10-4mol/LD.2.8×10-4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
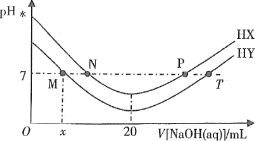
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,![]() 的溶液一定是酸溶液
的溶液一定是酸溶液
B.常温下,![]() 的醋酸溶液和
的醋酸溶液和![]() 的氢氧化钠溶液等体积混合后,溶液呈碱性
的氢氧化钠溶液等体积混合后,溶液呈碱性
C.在相同温度下,物质的量浓度相等的氢氧化钠、氨水溶液,![]()
D.向醋酸钠溶液中滴加醋酸至![]() ,则溶液呈中性
,则溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列有关胆矾的说法不正确的是
A.胆矾中有轨道杂化的氧原子和硫原子杂化方式为sp3
B.胆矾中含有的作用力有离子键、极性共价键、配位键、氢键
C.Cu2+价电子排布式为3d84s1
D.胆矾的结晶水在不同温度下会分步失去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com