

| A. | 外电源负极为A极 | |
| B. | 阳极的电极反应:2CH3OH+CO-2e-═(CH3O)2CO+2H+ | |
| C. | H+从右向左通过质子交换膜 | |
| D. | 电解槽中添加少量烧碱有利于导电 |
分析 通氧气的一极为阴极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应,图分析可知氢离子移向阴极,则与此电极连接的为负极电解槽的环境不能为碱性,否则得不到所需产物.
解答 解:A、通氧气的一极为阴极,与阴极相连的为负极,故负极为B极,故A错误;
B、图分析可知氢离子移向阴极,则与此电极连接的B电极为负极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:2CH3OH+CO-2e-=(CH3O)2CO+2H+,故B正确;
C、阳离子向阴极移动,故氢离子向右侧移动,故C错误;
D、电解槽不能为碱性环境,否则得不到碳酸二甲酯,故D错误.
故选B.
点评 本题考查原电池与电解池综合知识的应用,侧重于原电池的和电解池工作原理的考查,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 配制盐酸溶液用量筒量取盐酸时,俯视刻度线 | |
| B. | NaOH溶解后未经冷却就注入容量瓶并定容至刻度线 | |
| C. | 称量11.7 g NaCl配制0.2 mol•L-1NaCl溶液1 000 mL时,砝码错放在左盘 | |
| D. | 配制盐酸溶液定容时,仰视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | a | b | 实验现象预期 | 结论 | 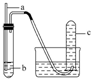 |
| A | 铜丝 | 稀硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 | |
| B | 木条 | 18.4mol•L-1 硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 | |
| C | 生铁 | 醋酸溶液 | c中有大量无色气体 | 生铁发生析氢腐蚀 | |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 碳极发生的反应:2H2O+2e-═H2↑+2OH- | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 理论上外电路中每转移1 mol电子,负极消耗的质量为7 g | |
| D. | 若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气与氯气应分别贮存在钢瓶中,并放在同一安全室集中保存 | |
| B. | 电石、Na2O2着火时,不能用常规的水枪灭火 | |
| C. | 可燃性颗粒(如面粉,漆粉)弥漫到空气中,可能会引起爆炸 | |
| D. | 油锅着火可用金属锅盖盖灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 实验现象 | 结论 |
| A | 向NaBr溶液中加入氯水,再加入淀粉KI溶液 | 溶液变蓝 | 氧化性:Cl2>Br2>I2 |
| B | 将铝片放入盐酸中 | 产生气泡的速率开始较慢,随后加快,后来又逐渐减慢 | H+的浓度是影响反应速率的唯一因素 |
| C | 向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜悬浊液,加热 | 得到蓝色溶液 | 蔗糖水解产物没有还原性 或蔗糖未水解 |
| D | 向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 | 品红溶液褪色 | 气体中含有Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.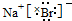 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的氯化铁溶液中,若Fe3+的数目为 NA,则Cl-的数目为3NA | |
| B. | 常温下,1 mol Fe与足量稀HNO3反应,转移电子的数目为2 NA | |
| C. | 8.0gCu2S和CuO的混合物中含有的铜原子数为0.1NA | |
| D. | 标准状况下,2.24 LCl2溶于水,转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的甲醇、甲醛、甲酸完全燃烧时的耗氧量依次递减 | |
| B. | 在淀粉溶液中加入适量稀硫酸微热一段时间,然后加入过量Na0H中和后,滴加几滴碘水,无明显现象,说明淀粉已经完全水解 | |
| C. | 总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 丙烯酸(CH3=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com