
| A. | 摩尔质量g/mol | B. | 气体摩尔体积mol/L | ||
| C. | 阿伏伽德罗常数/mol | D. | 密度g/cm3 |
分析 A.根据表达式M=$\frac{m}{n}$判断摩尔质量的单位;
B.根据气体摩尔体积的表达式Vm=$\frac{V}{n}$分析;
C.阿伏加德罗常数的单位是mol-1;
D.根据密度的表达式ρ=$\frac{m}{V}$进行判断.
解答 解:A.摩尔质量是单位物质的量的物质所具有的质量,单位是g/mol,故A正确;
B.气体摩尔体积是指单位物质的量的气体所占有的体积,单位是L/mol,故B错误;
C.由于阿伏加德罗常数是有单位的,且单位为mol-1,故C正确;
D.密度的表达式为:ρ=$\frac{m}{V}$,所以密度的单位是g/cm3,故D正确;
故选B.
点评 本题考查了常见的物理量相应的单位,题目难度不大,试题侧重基础知识的考查,明确常见物理量的表达式为解答关键,试题培养了学生的灵活应用能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 | B. | 0.12mol•L-1 | C. | 0.05mol•L-1 | D. | 0.16mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各为0.1 mol的羟基(-OH)和OH-中含有的电子数目均为0.9NA | |
| B. | 标准状况下,22.4 L O2与44.8 L SO2充分反应后转移电子的数目为4NA | |
| C. | 各为0.1 mol的羟基(-OH)和OH-中含有的电子数目均为0.9NA | |
| D. | 1L 0.1 mol/L的NaClO溶液中含有的ClO-离子数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL该溶液中含0.8g NaOH | |
| B. | 200mL该溶液与100mL 0.2 mol/L的硫酸溶液反应形成中性溶液 | |
| C. | 100mL该溶液中约含0.02 mol×6.02×1023mol-1个Na+ | |
| D. | 取NaOH 8g溶于1L水中即得到1L该溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
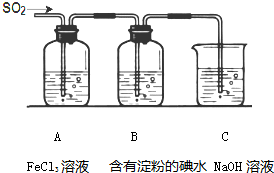 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐溶液是电解质 | |
| B. | 溶液和胶体的本质区别是有无丁达尔效应 | |
| C. | 可用NaOH溶液回收铝合金中的镁 | |
| D. | 小苏打溶液呈碱性的原因:HCO3-?OH-+CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com