
 CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
分析 (1)SO2与CO反应,生成固体S和CO2,据原子守恒和电子守恒书写化学方程式;
(2)据1molCO反应转移2mol电子,1molSO2反应,转移4mol电子分析;
(3)a、随温度升高K增大,说明正反应吸热;
b、化学平衡常数K=$\frac{生成物浓度度系数幂次方}{反应物浓度系数幂次方}$,固体不列入;
c、化学平衡常数只受温度影响;
d、图表中没有K=1的情况,K=1不知是否平衡;
(4)欲提高CO的平衡转化率,促进Fe2O3的转化,需要平衡正向移动,据此分析;
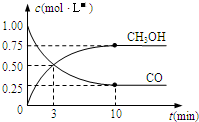
(5)根据图象中甲醇浓度变化量求出氢气的浓度变化量,再根据v=$\frac{△c}{△t}$计算氢气的反应速率;
(6)据影响弱酸电离平衡移动的因素分析.
解答 解:(1)SO2与CO反应,生成固体S和CO2,1molCO反应转移2mol电子,1molSO2反应,转移4mol电子,所以其化学计量数之比为2:1,化学方程式为:2CO+SO2=2CO2+S,故答案为:2CO+SO2=2CO2+S;
(2)1molCO反应转移2mol电子,1molSO2反应,转移4mol电子,标准状况下2.24L气体为0.1mol,每反应0.1mol二氧化硫,转移电子0.4mol,电子数为0.4NA,故答案为:0.4NA;
(3)a、随温度升高K增大,说明正反应吸热,故正确;
b、化学平衡常数K=$\frac{生成物浓度度系数幂次方}{反应物浓度系数幂次方}$=$\frac{[C{O}_{2}]}{[CO]}$,故正确;
c、化学平衡常数只受温度影响,故错误;
d、图表中没有K=1的情况,K=1不知是否平衡,故错误;
故答案为:cd;
(4)a.及时吸收或移出CO2,平衡正向移动,反应物转化率增大,故正确;
b.增大反应体系的压强,平衡不移动,故错误;
c.用更高效的催化剂,只能加快反应速率,不影响平衡移动,故错误;
d.粉碎矿石,增大接触面积,只能加快反应速率,不影响平衡移动,故错误;
故答案为:a;
(5)由图可知,达到平衡时甲醇的浓度变化为0.75mol/L,则△c(H2)=2×0.75mol/L=1.5mol/L,v(H2)=$\frac{1.5mol/L}{10min}$=0.15mol/(L•min),
故答案为:0.15mol/(L•min);
(6)a.加水稀释促进甲酸电离,但溶液酸性减弱,故正确;
b.加入少量甲酸钠固体,甲酸根离子浓度增大,甲酸电离平衡逆向移动,电离度减小,故错误;
c.通氯化氢,氢离子浓度增大,甲酸电离平衡逆向移动,电离度减小,故错误;
d.加入少量苛性钠固体,与甲酸发生中和反应,甲酸电离度增大,溶液酸性减弱,故正确;
故答案为:ad.
点评 本题考查范围广,知识跨度大,考查了氧化还原反应方程式书写及电子转移数目计算、化学平衡移动、化学反应速率计算、弱酸电离平衡移动.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | H2和CO2 | B. | CO2和H2O | C. | CO和CH3OH | D. | CH3OH和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
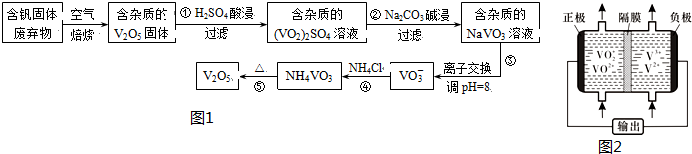
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
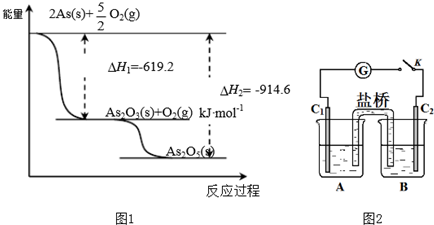
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
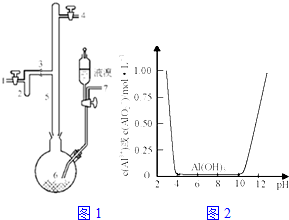 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热时间太短 | B. | 不应冷却后再滴入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀HNO3酸化 | D. | 加AgNO3溶液后未加稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者消耗NaOH的物质的量相同 | |
| B. | 中和HCl消耗NaOH的物质的量多 | |
| C. | 中和CH3COOH消耗NaOH的物质的量多 | |
| D. | 两者消耗NaOH的物质的量无法比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com