
(11分)现有下列物质:
①Cl2 ②SO2 ③0.1mol?L-1Na2CO3
④0.1mol?L-1NH3.H2O ⑤0.1mol?L-1CH3COOH ⑥BaSO4
(1)属于强电解质 属于弱电解质 属于非电解质 ,向⑤中加入等物质的量④,溶液导电性 (填“增强”或“减弱”)
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程。
。
(3)同学乙认为③溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
。
(4)在T℃时,反应2SO2(g)+O2(g)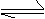 2SO3(g) △H<0的平衡常数K=6×102则:
2SO3(g) △H<0的平衡常数K=6×102则:
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)。
②T℃时,某生向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时该反应是否处于化学平衡状态 (填“是”或“否”),化学反应速率V(正) V(逆)(填“大于”、“等于”或“小于”)。
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 反应现象 | 结论 |
| A+B | 产生无色气体 | B是 NaHCO3 NaHCO3 |
| A+C | 无明显现象 | C是 Na2SO4 Na2SO4 |
| A+D | 产生白色沉淀 | D是 BaCl2 BaCl2 |
| 甲组 | 乙组 | 丙组 | 丁组 | |
| X | BaCl2 | Na2CO3 | KCl | K2CO3 |
| Y | 硝酸 | 硝酸 | 盐酸 | 盐酸 |
| Z | Na2CO3 | AgNO3 | K2CO3 | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com