
【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表。

(1)Z的氧化物在通讯领域用来作__。
(2)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为__。一种含X元素的化合物是家用消毒液的有效成分,它能有效杀灭2019-coVn,请写出工业上制备它的离子反应方程式__,但在使用时特别注意不能与洁厕灵混用,原因是__(用化学方程式表示)。
(3)W在周期表中的位置为__,聚硅酸W是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废W渣(主要成分W3O4,含少量碳及二氧化硅)为原料制备的流程如图:

①加热条件下酸浸时,W3O4与硫酸反应生成W的离子。
②酸浸时,通入O2的目的是___。
③“W3+浓度检测”是先将100mL含W3+溶液用适量的SnCl2还原为W2+;再用酸性K2Cr2O7标准溶液测定W2+的量(Cr2O72-被还原为Cr3+),此时发生反应的离子方程式___,若用掉0.2mol·L-1K2Cr2O7溶液50mL,则W3+浓度为___。
【答案】光导纤维 Al2O3+6H+=2Al3++3H2O Cl2+2OH-=Cl-+ClO-+H2O NaClO+2HCl=Cl2↑+NaCl+H2O 第四周期第Ⅷ族 将FeSO4氧化为Fe2(SO4)3 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O 0.6mol/L
【解析】
X、Y、Z为短周期元素,X的最高价氧化物对应的水化物为无机酸中最强酸,则X为Cl;Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料,Y原子的最外层电子数等于电子层数,则Y为Al;Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料,原子的最外层电子数是次外层电子数的1/2,则Z为Si;W原子的最外层电子数小于4,常见化合价有+3、+2,WX3稀溶液呈黄色,则W为Fe,据此进行解答。
根据以上分析可知X是Cl,Y是Al,Z是Si,W是Fe。
(1)Z的氧化物二氧化硅在通讯领域用来作光导纤维。
(2)X的最高价氧化物对应水化物的水溶液高氯酸与Y的氧化物氧化铝反应的离子方程式为Al2O3+6H+=2Al3++3H2O。一种含X元素的化合物是家用消毒液的有效成分,它能有效杀灭2019-coVn,该化合物是次氯酸钠,工业上制备它的离子反应方程式为Cl2+2OH-=Cl-+ClO-+H2O,由于次氯酸钠能氧化盐酸生成氯气,而洁厕灵中含有盐酸,所以在使用时特别注意不能与洁厕灵混用,反应的化学方程式为NaClO+2HCl=Cl2↑+NaCl+H2O。
(3)铁在周期表中的位置为第四周期第Ⅷ族。
②加热条件下酸浸时,Fe3O4与硫酸反应生成硫酸铁和硫酸亚铁,碳与二氧化硅不溶于稀硫酸也不反应,滤渣的主要成分是碳和二氧化硅;由于酸浸时有亚铁离子生成,通入氧气能将亚铁离子氧化为铁离子;
③在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),则亚铁离子被氧化为铁离子,发生的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;根据反应和原子守恒可知

解得c=0.6mol/L


科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol BaSO4粉末置于盛有500 mL蒸馏水的烧杯中,然后烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
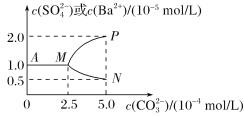
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
D. 若使0.1 mol BaSO4全部转化为BaCO3,至少要加入2.6 mol Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是镁——次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含![]() 的工业废水的处理。下列说法正确的是( )
的工业废水的处理。下列说法正确的是( )

A. 图乙中![]() 向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去
B. 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
C. 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生
D. 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为测定未知浓度的盐酸溶液,实验如下:用1.00 mL待测盐酸配制100 mL稀盐酸,以0.10 mol/L的NaOH溶液滴定25.00 mL上述稀盐酸,滴定终止时消耗NaOH溶液15.00mL。
(1)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果______(填“偏大”、“偏小”或“无影响”,下同);若观察碱式滴定管读数时,滴定前仰视而滴定后俯视,则结果会导致测得的稀盐酸溶液浓度值_________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入下图中的________(选填“甲”或“乙”);下图在滴定操作时,排去碱式滴定管中气泡的方法应采用操作______(选填“甲”、“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)配制100 mL一定浓度的稀盐酸溶液,除使用量筒、烧杯、玻璃棒、和胶头滴管外还需用到的仪器是______________,计算待测盐酸(稀释前的盐酸)溶液的物质的量浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列化学用语中正确的是( )
A. 氢氧燃料电池在碱性介质中负极的反应式是:O2+2H2O+4e- = 4OH-
B. NaHCO3在水溶液中的水解离子方程式:HCO3-+H2O![]() CO2↑+ OH-
CO2↑+ OH-
C. 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+ Hg2+(aq)=HgS(s)+Fe2+(aq)
D. 钢铁发生电化学腐蚀的正极反应式:Fe-2 e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( )

A. a极与电源的负极相连
B. a电极反应式:2H2O+2e-= H2↑+2OH-
C. 离子交换膜d为阴离子交换膜
D. 产物丙为硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出Na-CO2电池如下图所示。下列说法错误的是

A. 电池放电时,钠发生氧化反应
B. 正极的电极反应式:2CO2 + 2H2O + 2e- = 2HCO3- + H2↑
C. 理论上消耗23g钠,同时产生22.4L氢气(标准状况)
D. 该装置既可以吸收二氧化碳,又能产生电能、氢燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )

A. 滤纸上c点附近会变红色
B. Cu电极质量减小,Pt电极质量增大
C. Z中溶液的pH先减小,后增大
D. 溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-![]() Al(OH)3
Al(OH)3
B. 以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
D. 钢铁发生吸氧腐蚀的正极反应式:Fe-2e-=Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com