
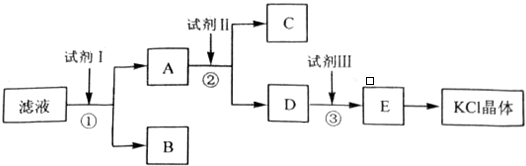
分析 氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量氯化钡溶液;然后过滤后获得氯化钡、氯化钾溶液A,然后加入过量的碳酸钾溶液除去溶液中的氯化钡,过滤,得到氯化钾和碳酸钾混合液,再加入过量盐酸,除去过量的碳酸钾,最后通过加入浓缩、蒸发结晶和氯化钾,
(1)用氯化钡溶液,能同时除去硫酸根离子和碳酸根离子,根据离子方程式的书写规则书写.
(2)为除去过量的钡离子选用K2CO3作试剂,不仅能除去钡离子同时还生成氯化钾.
(3)最后用盐酸除去过量的碳酸根离子,根据离子方程式的书写规则书写,注意弱电解质和气体写化学式.
(4)先根据硝酸银的物质的量计算25mL氯化钾溶液中含有的氯化钾的物质的量,再计算100mL氯化钾溶液中含有的氯化钾的物质的量,从而计算出其质量,根据质量分数公式计算其质量分数即可.
解答 解:氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质,除去碳酸根离子和硫酸根离子,需要加入过量氯化钡溶液;然后过滤后获得氯化钡、氯化钾溶液A,然后加入过量的碳酸钾溶液除去溶液中的氯化钡,过滤,得到氯化钾和碳酸钾混合液,再加入过量盐酸,除去过量的碳酸钾,最后通过加入浓缩、蒸发结晶和氯化钾,
(1)要除掉杂质离子硫酸根和碳酸根,应加入过量的氯化钡溶液,碳酸根和硫酸根生成不溶于水的钡盐,同时生成氯化钾,
离子方程式为:SO42-+Ba2+=BaSO4↓,CO32-+Ba2+=BaCO3↓.
故答案为:BaCl2;Ba2++CO32-=BaCO3↓; Ba2++SO42-=BaSO4↓;
(2)要除掉多余的钡离子,要加入碳酸钾,碳酸钾和氯化钡反应生成碳酸钡沉淀同时生成氯化钾,离子方程式为CO32-+Ba2+=BaCO3↓.
故答案为:K2CO3,除去A中的Ba2+离子;
(3)要除掉多余的碳酸根,要滴加适量的盐酸,碳酸根离子和盐酸反应生成二氧化碳和水,离子方程式为CO32-+2H+=CO2↑+H2O.
故答案为:盐酸; CO32-+2H+=H2O+CO2↑;
(4)设25mL氯化钾溶液中氯化钾的物质的量为nmol.
KCl+AgNO3=AgCl+KNO 3
1mol 1mol
nmol 0.1000mol•L-1 ×0.02562L
n=0.002562mol
100mL溶液中含有氯化钾的物质的量=0.002562mol×4=0.010248mol
100mL溶液中含有氯化钾的质量=0.010248mol×74.5g/mol=0.764376g
质量分数=$\frac{0.764376g}{0.7759g}×100%$=98.40%.
故答案为:98.40%.
点评 本题综合考查物质的分离、提纯的实验设计,侧重于学生的分析、计算和实验能力的考查,难度不大,注意解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原产物 | B. | 还原剂和氧化产物 | ||
| C. | 氧化剂和催化剂 | D. | 还原剂和催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素Z的最高价氧化物的水化物显两性 | |
| B. | XY3中的X呈+3价 | |
| C. | Y最高价氧化物水化物的酸性比W的强 | |
| D. | Z与Q形成的是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(M)=0.4 mol/(L•min) | B. | v(N)=0.4 mol/(L•min) | ||
| C. | v(M)=0.8 mol/(L•min) | D. | v(E)=0.45 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
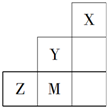
| A. | Y单质的氧化性比M单质的氧化性强 | |
| B. | X原子最外层可达到8电子的稳定结构 | |
| C. | 原子半径:Z>M>Y | |
| D. | M的气态氢化物的稳定性强于Z |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用燕馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com