
海洋中资源丰富,以海水为原料可制得一系列产品,如下图所示:
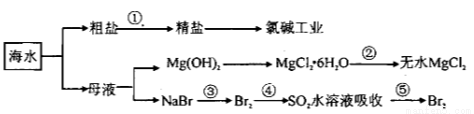
下列有关说法正确的是
A.第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.将第②步结晶出的MgCl2 6H2O在空气中加热分解制备无水MgCl2
6H2O在空气中加热分解制备无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.电解饱和食盐水时,在阴极区生成NaOH
D
【解析】
试题分析:A、除去粗盐中的可溶性杂质:Mg2+、Ca2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离
子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序;故A错误;B、结晶出的MgCl2?6H2O在空气中加热分解得到氯化镁和水,氯化镁水解得不到无水MgCl2,应在氯化氢气流中脱水,防止镁离子水解,故B错误;C、③是溴元素被氧化为溴单质,④是溴单质被还原为溴离子,⑤是溴元素被氧化为溴单质;此过程是富集溴的操作,故C错误;D、电解饱和食盐水溶液中阴离子Cl-移向阳极,阳离子H+移向阴极得到电子发生还原反应生成氢气,电极附近氢氧根离子浓度增大,形成氢氧化钠,故D正确;故选D。
考点:考查海水提取溴的工艺流程,氯碱工业的反应原理


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2015届江苏省盐城市、建湖二中高二上期中化学试卷(必修)(解析版) 题型:选择题
碳酸氢铵(NH4HCO3)是一种氮肥,其属于
A.氧化物 B.酸 C.碱 D.盐
查看答案和解析>>
科目:高中化学 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2SO3、KAlO2、MgCl2、K2CO3、NaNO2中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图所示:

根据上述实验,以下说法正确的是
A.溶液甲中一定含有K2SO3、NaNO2
B.无法判断溶液中是否有K2SO3
C.气体A和气体B-定为混合物
D.原混合物中一定有Fe2O3
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:实验题
(12分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。

已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是
A.X的氢化物溶于水生成弱酸
B.Z的氢化物的水溶液在空气中存放不易变质
C.Y与X可生成Y3X2型化合物
D.Z的单质在氧气中燃烧可以生成两种酸性氧化物
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(本题共14分)某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)Al + X + OH- =AlO2-+ NH3 + N2 + 。该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是
A.空气 SO2、NO、NO2
B.KNO3溶液 Fe2+、H+、I-
C.NaHCO3溶液 Ca2+、OH-、Cl-
D.由水电离产生的c(H+) = 10-11mol·L-1的溶液 K+、SO42-、Br-
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
“纳米材料”是粒子直径为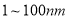 的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质
的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应
④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①④⑤ B.②③⑤ C.②③④ D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com