
【题目】A部分:由锆英砂(ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)制备ZrO2的流程如下:

已知:①ZrO2在强碱性溶液中以ZrO32-形式存在,在强酸性溶液中以ZrO2+形式存在。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
Mn+ | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.8 | 5.6 | 8.0 |
(1)操作I所需要的玻璃仪器为___________,操作I除了得到溶液a还可得到_________。
(2)加氨水至溶液a中调节pH的的范围是________________。
(3)操作II会得到滤液b和滤渣II,滤渣II分离过程如下:
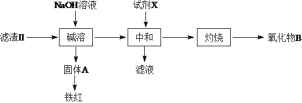
氧化物B的化学式为__________。若试剂X为盐酸,缺点是___________。
(4)操作III除得到Zr(OH)4外还得到某种溶液,向该溶液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为_____________________________。
(5)加入氨水至溶液b发生的离子方程式为__________________________。
(6)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是______________。
B部分:钛精矿是从钛铁矿或钛磁铁矿中采选出来,主要成分为FeTiO3,是生产用途非常广泛的钛白粉的原料。以钛精矿石为原料制备金属钛的流程如下图所示(某些过滤过程已忽略)。已知强酸性溶液中,+4价的钛元素以TiO2+形式存在,金属钛不溶于稀非氧化性酸。回答下列问题:

(1)步骤②中加入铁屑的作用是__________________。
(2)晶体K俗称绿矾,晶体K的化学式为____________。
(3)试写出溶液C加热制备钛酸沉淀的化学方程式__________________________________。
(4)步骤⑥加入过量的活性炭,则发生的化学方程式为_______________,已知TiO2+2Cl2![]() TiCl4+O2为吸热反应,且该条件下反应也能够发生,为何制备TiCl4过程中还要加入活性炭,试解释原因_________________。
TiCl4+O2为吸热反应,且该条件下反应也能够发生,为何制备TiCl4过程中还要加入活性炭,试解释原因_________________。
(5)气体F为氩气,F的作用是_____________________。
(6)溶液H是_________,作用为___________________________。
【答案】烧杯、漏斗、玻璃棒 H2SiO3 5.6~6.2 Al2O3 盐酸的量不易控制 2NH4++CaCO3![]() 2NH3↑+Ca2++CO2↑+H2O ZrO2++2NH3·H2O+H2O=Zr(OH)4↓+2NH4+ 取最后一次洗涤液,加入硝酸酸化的AgNO3,未产生白色沉淀,则洗涤干净 防止Fe2+被氧化 FeSO4·7H2O TiOSO4+2H2O
2NH3↑+Ca2++CO2↑+H2O ZrO2++2NH3·H2O+H2O=Zr(OH)4↓+2NH4+ 取最后一次洗涤液,加入硝酸酸化的AgNO3,未产生白色沉淀,则洗涤干净 防止Fe2+被氧化 FeSO4·7H2O TiOSO4+2H2O![]() H2TiO3↓+H2SO4 TiO2+2Cl2+2C
H2TiO3↓+H2SO4 TiO2+2Cl2+2C![]() TiCl4+2CO 活性炭与O2反应并放热,促进反应正向移动利于制备TiCl4 做保护气 稀盐酸 溶解MgCl2和未反应的Mg,过滤后提纯金属钛
TiCl4+2CO 活性炭与O2反应并放热,促进反应正向移动利于制备TiCl4 做保护气 稀盐酸 溶解MgCl2和未反应的Mg,过滤后提纯金属钛
【解析】
A部分: (1)从反应流程可知,操作I为过滤,所需要的玻璃仪器为烧杯、漏斗、玻璃棒;二氧化硅与氢氧化钠反应生成硅酸钠,硅酸钠与盐酸反应生成了胶状沉淀硅酸,因此操作I除了得到溶液a还可得到H2SiO3;综上所述,本题答案是:烧杯、漏斗、玻璃棒,H2SiO3。
(2)加氨水的目的是除去溶液中的铁离子和铝离子,使两种离子变为沉淀,根据表格数据可知,当溶液a中调节pH的的范围是5.6~6.2之间时,即可实现目的;综上所述,本题答案是:5.6~6.2。
(3)滤渣II为氢氧化铁和氢氧化铝混合物,氢氧化铝能够与强碱反应生成偏铝酸钠溶液,偏铝酸钠溶液中加入过量的二氧化碳得到氢氧化铝沉淀,加热氢氧化铝得到氧化铝固体;所以氧化物B的化学式为Al2O3;若试剂X为盐酸,盐酸适量,偏铝酸钠与盐酸反应产生氢氧化铝沉淀,盐酸过量,氢氧化铝沉淀溶解,因此使用盐酸制备氢氧化铝就需控制盐酸的使用量;综上所述,本题答案是:Al2O3;盐酸的量不易控制。
(4)根据流程分析可知,操作III除得到Zr(OH)4外还得到氯化铵溶液,氯化铵溶液水解显酸性,向该溶液中加入CaCO3粉末并加热,得到二氧化碳和氨气。该反应的离子方程式为2NH4++CaCO3![]() 2NH3↑+Ca2++CO2↑+H2O;综上所述,本题答案是:2NH4++CaCO3
2NH3↑+Ca2++CO2↑+H2O;综上所述,本题答案是:2NH4++CaCO3![]() 2NH3↑+Ca2++CO2↑+H2O。
2NH3↑+Ca2++CO2↑+H2O。
(5) 强酸性溶液b中含有ZrO2+,该离子能够与氨水反应生成Zr(OH)4沉淀,离子方程式为:ZrO2++2NH3·H2O+H2O=Zr(OH)4↓+2NH4+;综上所述,本题答案是:ZrO2++2NH3·H2O+H2O=Zr(OH)4↓+2NH4+。
(6)为得到纯净的ZrO2,Zr(OH)4需要洗涤附着的氯化铵溶液,是否洗涤干净,可用稀硝酸和硝酸银溶液检验洗涤液中是否存在氯离子;具体操作如下:取最后一次洗涤液,加入硝酸酸化的AgNO3,未产生白色沉淀,则洗涤干净;综上所述,本题答案是:取最后一次洗涤液,加入硝酸酸化的AgNO3,未产生白色沉淀,则洗涤干净。
B部分: (1) 钛精矿主要成分为FeTiO3,铁为+2价,固体产物A中溶于水后溶液中含有Fe2+,Fe2+易被氧化,因此步骤②中加入铁屑的作用是防止Fe2+被氧化;综上所述,本题答案是:防止Fe2+被氧化。
(2)晶体K俗称绿矾,它为带有7个结晶水的硫酸亚铁晶体,化学式为FeSO4·7H2O;综上所述,本题答案是:FeSO4·7H2O。
(3) C为TiOSO4溶液,加热后生成H2TiO3固体和H2SO4溶液,化学方程式:TiOSO4+2H2O![]() H2TiO3↓+H2SO4;综上所述,本题答案是:TiOSO4+2H2O
H2TiO3↓+H2SO4;综上所述,本题答案是:TiOSO4+2H2O![]() H2TiO3↓+H2SO4。
H2TiO3↓+H2SO4。
(4) 钛酸固体加热分解为TiO2,TiO2与氯气、活性炭反应生成四氯化钛,化学方程式为:TiO2+2Cl2+2C![]() TiCl4+2CO;已知TiO2+2Cl2
TiCl4+2CO;已知TiO2+2Cl2![]() TiCl4+O2为吸热反应,活性炭与O2反应并放热,有利于反应向右移动,提高了四氯化钛的产率;综上所述,本题答案是:TiO2+2Cl2+2C
TiCl4+O2为吸热反应,活性炭与O2反应并放热,有利于反应向右移动,提高了四氯化钛的产率;综上所述,本题答案是:TiO2+2Cl2+2C![]() TiCl4+2CO;活性炭与O2反应并放热,促进反应正向移动利于制备TiCl4。
TiCl4+2CO;活性炭与O2反应并放热,促进反应正向移动利于制备TiCl4。
(5)气体F为氩气,性质稳定,做保护气;综上所述,本题答案是:做保护气。
(6) TiCl4与镁反应生成金属钛和氯化镁,金属钛不溶于稀非氧化性酸;所以H溶液可以选择稀盐酸,溶解MgCl2和未反应的Mg,过滤后提纯金属钛;综上所述,本题答案是:稀盐酸; 溶解MgCl2和未反应的Mg,过滤后提纯金属钛。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 。下列关于苯佐卡因的叙述正确的是
。下列关于苯佐卡因的叙述正确的是
A. 分子式为C9H14NO2
B. 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种
C. 1mol该化合物最多与4mol氢气发生加成反应
D. 分子中将氨基转化成硝基的反应为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生为探究苯与溴发生反应的原理,用如图装置进行实验.
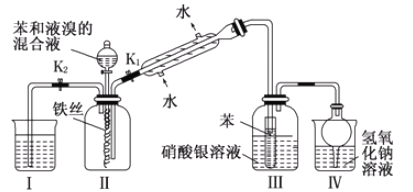
根据相关知识回答下列问题:
(1)实验开始时,关闭K1,开启K2和分液漏斗活塞,滴加苯和液溴的混合液,反应开始,反应的化学方程式_____。过一会儿,在(Ⅱ)中瓶底观察到_____(Ⅲ)中可能观察到的现象是____
(2)整套实验装置中能防止倒吸的装置有_____(填装置序号)。
(3)反应结束后要使装置(I)中的水倒吸入装置(Ⅱ)中,这样操作的目的是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氮的氧化物和灼热的铁按4NxOy+3yFe=yFe3O4+2xN2的反应式进行反应。在一个特定的实验中,2mol该氧化物与足量红热的铁完全反应,生成1molN2和1molFe3O4。该氧化物的化学式为( )
A.NOB.NO2C.N2OD.N2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是最基本的有机化工原料之一。工业上可用二氧化碳和氢气反应来生产甲醇。
(1)已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g)= 2H2O(g) ΔH=-bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
(2)某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2,发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如下图中的曲线I,则前4分钟ν(CO2)=__________;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___________;该温度下反应的化学平衡常数为___________。
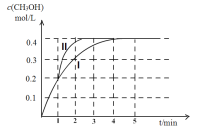
(3)在恒压的条件下,下列选项能说明CO2+3H2![]() CH3OH+H2O反应已达平衡状态的是______。
CH3OH+H2O反应已达平衡状态的是______。
A、ν正(H2): ν逆(CH3OH)=3:1
B、混合气体的密度不再变化
C、混合气的平均摩尔质量不再变化
D、反应中H2O与CH3OH的物质的量浓度之比为1:1,且比值保持不变
(4)在另一温度下发生合成甲醇的反应,关闭K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。
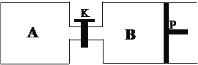
(5)一定条件下甲醇可进一步氧化转化为甲酸。室温下,将amol/L的甲酸与bmol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图所示装置发生铜与稀H2SO4的反应。该装置工作时,下列说法正确的是( )
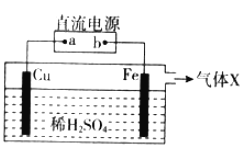
A. a为直流电源的正极B. 气体X为O2
C. SO42-向Fe电极附近移动D. 该装置能证明Cu比Fe活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下 列离子方程式书写正确的是( )
A. 氯气通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 铁和稀硫酸反应:2Fe+6H+ = 2 Fe3++3H2↑
C. 碳酸钙与醋酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O
D. 氢氧化铝和氢氧化钠溶液反应:Al(OH)3+OH- = AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学基础]M为合成高分子材料的中间体,以芳香烃A制备M和高分子化合物N的一种合成路线如下:

已知:
请回答下列问题:
(1)C的化学名称为________。
(2)A→B、H→M的反应类型分别为________、________。
(3)F中所含官能团的名称为________。G的结构简式为________。
(4)试剂1为________。
(5)D→N的化学方程式为________。
(6)Q为H的同分异构体,同时满足下列条件的Q的结构简式为________。
①苯环上连有两个取代基,除苯环外无其他环状结构
②能与氯化铁溶液发生显色反应,1 mol Q最多消耗3 molNaOH
③核磁共振氢谱有5组峰,峰面积之比为6∶2∶2∶1∶1
(7)参照上述合成路线和信息,以甲醛和乙醛为起始原料(无机试剂任选),设计制备聚丙烯酸(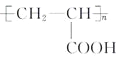 )的合成路线:________。
)的合成路线:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com