
| 实验混合溶液 | A | B | C | D | E | F |
| 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同;
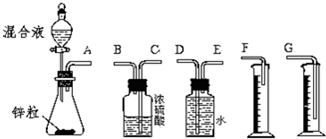
(2)①装置的组装顺序:用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部;
②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;
③反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积;
(3)Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4;对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等.
解答 解:(1)要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同,A组中硫酸为30ml,那么其它组硫酸量也都为30ml,而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,V1=V5=30mL,那么总量为50ml,所以V1=30ml,V6=10ml,V7=20ml,V9=50ml-30mL-2.5mL=17.5mL,.
故答案为:30;10;17.5;
(2)①装置的组装顺序:用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E),(D)接(G);
故答案为:E、D、G;
②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大,导致硫酸不能顺利滴入锥形瓶;
故答案为:锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大;
③反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积;
故答案为:ACD;
(3)Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4;对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,
故答案为:Ag2SO4;升高反应温度;适当增加硫酸的浓度.
点评 主要考查化学反应速率实验、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应用李比希法、钠熔法、铜丝燃烧法、元素分析仪都可确定有机化合物的元素组成 | |
| B. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物组成元素和结构的分析 | |
| C. | 运用同位素示踪法可确定有机物的反应机理 | |
| D. | 可用酸性高锰酸钾溶液或溴水鉴定某有机物分子中是否含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{14M}{{a}^{3}{N}_{A}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.| 实验编号 | T/X | H2O2初始浓度/moL•L-1 | FeCl3初始浓度/moL•L-1 |
| I | 20 | 1.0 | 0 |
| n | 50 | 1.0 | 0 |
| in | 50 | 1.0 | 0.1 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,取代反应;
,取代反应;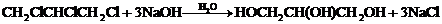 ,取代反应或水解反应;
,取代反应或水解反应; +3H2O,酯化反应.
+3H2O,酯化反应. ,消去反应.
,消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与强碱溶液反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 氯水与SO2溶液反应:Cl2+SO2+2H2O═4H++ClO-+SO32- | |
| C. | 二氧化锰与浓盐酸反应:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑ | |
| D. | 将二氧化氮气体通入水中:2NO2+H2O═H++NO3-+NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com