
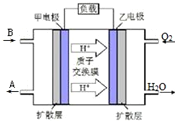
 已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.
已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.分析 (1)高温条件下,铝和氧化铁发生铝热反应而放出大量热,能用于焊接钢轨;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,则A是氨气,氨气在催化剂、加热条件下能和氧气反应生成NO和水;
(3)若A是淡黄色粉末,常用作供氧剂,则A是过氧化钠,C为强碱,为NaOH,则B是水,D为氧气,根据反应物和生成物书写方程式;
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A的相对分子质量比B大14,A能和B反应生成C和D,A为乙酸、B为乙醇;
①在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应;
②该燃料电池中,负极上乙醇失电子发生氧化反应;
(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl-,根据反应物和生成物及转移电子守恒书写离子方程式.
解答 解:(1)高温条件下,铝和氧化铁发生铝热反应而放出大量热而使铁熔融,所以能用于焊接钢轨,故答案为:焊接钢轨;
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,则A是氨气,氨气在催化剂、加热条件下能和氧气反应生成NO和水,反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)若A是淡黄色粉末,常用作供氧剂,则A是过氧化钠,C为强碱,为NaOH,则B是水,D为氧气,根据反应物和生成物书写方程式为2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A的相对分子质量比B大14,A能和B反应生成C和D,A为乙酸、B为乙醇;
①在浓硫酸作催化剂、加热条件下,乙酸和乙醇发生酯化反应,反应方程式为CH3COOH+C2H5OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O,故答案为:CH3COOH+C2H5OH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O;
②该燃料电池中,负极上乙醇失电子发生氧化反应,该电解质溶液呈酸性,所以生成氢离子和二氧化碳,电极反应式为C2H5OH-4e-+H2O=CH3COOH+4H+,故答案为:C2H5OH-4e-+H2O=CH3COOH+4H+;
(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl-,根据反应物和生成物及转移电子守恒书写离子方程式为2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+,故答案为:2ClO2+5Mn2++6H2O=5MnO2↓+2Cl-+12H+.
点评 本题考查较综合,涉及无机物和有机物推断、原电池原理、氧化还原反应等知识点,为高频考点,明确物质性质、基本理论是解本题关键,难点是电极反应式的书写,注意结合电解质溶液酸碱性书写.


科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2 | B. | KOH | C. | Ba(OH)2 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
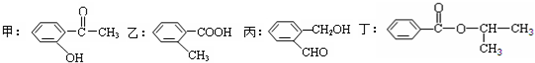
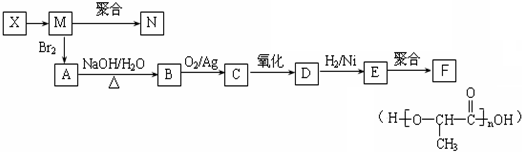
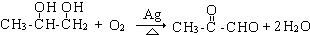 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Na+HCO3- Cl- | B. | Cu2+ Na+NO3- SO42- | ||
| C. | Mg2+ H+ SO42-OH- | D. | Ag+ Al3+ Cl-H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变和熵变都与反应的自发性有关,又都不能独立作为自发性的判据 | |
| B. | -10℃时的液态水会自动结冰成为固态,这是熵增的过程 | |
| C. | 过程的自发性既可用于判断过程的方向,也可确定过程是否能发生和过程发生的速率 | |
| D. | △H>0的反应一定不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 1mol•L-1Na2SO4溶液中Na+个数为2 NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com