
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
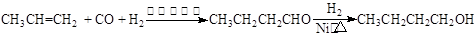
CO的制备原理:HCOOH CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)
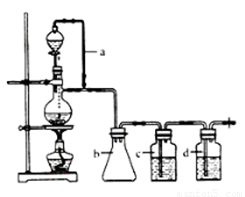
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式: 。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是 ,装置中b的作用是 ,c中盛装的试剂是 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水;④无水CuSO4;⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,
RCH(OH)SO3Na↓;②沸点:乙醚34℃,
1-丁醇118℃,并设计出如下提纯路线:

试剂1为 ,操作2为 ,操作3为 。
(1)(CH3)2CHOH CH2=CHCH3↑+H2O;(2分)
CH2=CHCH3↑+H2O;(2分)
(2)保证分液漏斗内外压强平衡,便于液体顺利流下。(2分)
作为安全瓶,防倒吸 (2分) NaOH溶液 (2分)
(3)④⑤①⑤③②(答④⑤①③②也给分)(2分)
(4)饱和NaHSO3溶液(2分) 萃取(2分) 蒸馏(2分)
【解析】
试题分析:(1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,方程式为Zn+2HCl=ZnCl2+H2↑;2-丙醇通过消去反应即到达丙烯,方程式为:(CH3)2CHOH CH2=CHCH3↑+H2O,故答案为:Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOH
CH2=CHCH3↑+H2O,故答案为:Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOH CH2=CHCH3↑+H2O;
CH2=CHCH3↑+H2O;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;若用以上装置制备氢气,就不再需要加热,所以此时发生装置中的玻璃仪器名称是分液漏斗和蒸馏烧瓶;氢气密度小于空气的,因此要收集干燥的氢气,就只能用向下排空气法,而不能用排水法收集;故答案为:恒压,防倒吸; NaOH溶液,浓H2SO4;分液漏斗、蒸馏烧瓶; ;
;
(3)检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①②③(或④⑤①③②),故答案为:④⑤①②③(或④⑤①③②);
(4)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇.因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
故答案为:饱和NaHSO3溶液;过滤;萃取;蒸馏.
考点:本题考查有机物合成方案的设计,题目难度较大,综合性较强,答题时注意把握物质的分离、提纯方法,把握物质的性质的异同是解答该题的关键.


科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
- 2 |
- 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(11分)某研究性学习小组为证明2Fe3+ + 2I- 2Fe2++ I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
按要求回答下列问题。
方案甲:
取5mL0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡。静置、分层,再取上层清液,滴加KSCN溶液。
(1)甲方案中能证明该反应为可逆反应的现象是 。
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是 。
方案乙:
取5mL0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到 现象,即可证明该反应为可逆反应,请解释产生该现象的原因 。
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向 方向偏转(填“左”、“右”或“不移动”),即可判断该反应为可逆反应,此时甲中石墨电极上的电极反应式为 。
【解析】(1)根据实验数据可知碘化钾是过量的,若反应是可逆反应,则溶液中一定存在铁离子,同时也必须生成单质碘。所以可以通过检验铁离子和单质碘来证明。
(2)因为碘离子和亚铁离子在空气中也可以被氧气氧化生成单质碘和铁离子,所以方案不是很严密。
(3)可以依据外界条件对平衡的影响来验证。因为Fe3+与F-络合生成无色的FeF63-,促使2Fe3+ +2I- 2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
(4)在原电池中负极是失去电子的,碘离子失去电子,所以电子是从甲池流向乙池,所以电流计的指针向左偏转。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省杭州地区七校高二下学期期中联考化学试卷(解析版) 题型:实验题
(11分)某研究性学习小组为证明2Fe3+ + 2I-  2Fe2+
+ I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
2Fe2+
+ I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
按要求回答下列问题。
方案甲:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡。静置、分层,再取上层清液,滴加KSCN溶液。
(1)甲方案中能证明该反应为可逆反应的现象是 。
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是 。
方案乙:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到 现象,即可证明该反应为可逆反应,请解释产生该现象的原因 。
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向 方向偏转(填“左”、“右”或“不移动”),即可判断该反应为可逆反应,此时甲中石墨电极上的电极反应式为 。

【解析】(1)根据实验数据可知碘化钾是过量的,若反应是可逆反应,则溶液中一定存在铁离子,同时也必须生成单质碘。所以可以通过检验铁离子和单质碘来证明。
(2)因为碘离子和亚铁离子在空气中也可以被氧气氧化生成单质碘和铁离子,所以方案不是很严密。
(3)可以依据外界条件对平衡的影响来验证。因为Fe3+与F-络合生成无色的FeF63-,促使2Fe3+ +
2I-  2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
2Fe2+ + I2平衡朝逆反应方向移动,所以溶液颜色会变浅。
(4)在原电池中负极是失去电子的,碘离子失去电子,所以电子是从甲池流向乙池,所以电流计的指针向左偏转。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com