
”¾ĢāÄæ”æÄÉĆ׶žŃõ»ÆļÆ(ZrO2)ŹĒÖʱøĢŲÖÖĢÕ“É(china)×īÖŲŅŖµÄŌĮĻÖ®Ņ»”£ÓÉļÆÓ¢ŹÆ(Ö÷ŅŖ³É·ÖĪŖZrSiO4)Öʱø¶žŃõ»ÆļƵŤŅÕĮ÷³ĢČēĶ¼ĖłŹ¾£ŗ
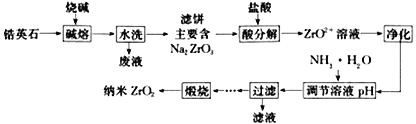
£Ø1£©Š“³ö”°¼īČŪ”±Ź±Ö÷ŅŖ·“Ó¦µÄ»Æѧ·½³ĢŹ½__________________________________”£
£Ø2£©”°Ė®Ļ“”±Ėł²śÉśµÄ”°·ĻŅŗ”±Ö÷ŅŖ³É·ÖĪŖNaOH ŗĶ__________£ØĢī»ÆѧŹ½£©£¬ŹŌŠ““Ė³É·ÖµÄŅ»ÖÖÓĆĶ¾________________________________”£
£Ø3£©Š“³ö”°Ėį·Ö½ā”±Éś³ÉZrO2+·“Ó¦µÄĄė×Ó·½³ĢŹ½__________________________________”£
£Ø4£©øł¾ŻĶ¼£Ø1£©·ÖĪöZrO2+ÅØ¶Č¶ŌZrO2Į£¾¶µÄÓ°Ļģ_____________________________________”£
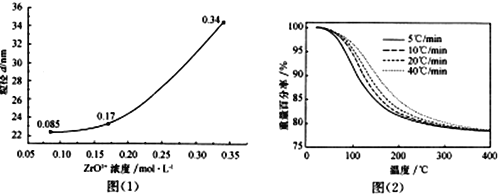
£Ø5£©ZrO2+ČÜŅŗÖŠ³£ŗ¬ÓŠFe3+£ØÅضČĪŖ0.03mol”¤L-l£©£¬Ņ»°ćÓĆ²ŻĖįĀēŗĻ“¦Ąķ¾»»Æ”£ČōĪ“¾»»Æ“¦ĄķÖ±½Ó¼ÓČė°±Ė®µ÷½ŚČÜŅŗpH£¬ÄÜ·ńŹ¹ZrO2+ĶźČ«×Ŗ»ÆĪŖ“æ¾»µÄZrO(OH)2³Įµķ£¬ŹŌĶعż¼ĘĖćĖµĆ÷”£ŅŃÖŖZrO2+ĶźČ«³ĮµķŹ±ÅضČĪŖ1.0”Į10 -5 mol”¤L-l £¬ZrO(OH)2”¢Fe(OH)3µÄKsp·Ö±šĪŖ4.0”Į10-26”¢8.0”Į10-38£¬ ![]() ”Ö3.16”£__________________________________________________”£
Ӆ3.16ӣ__________________________________________________ӣ
£Ø6£©ZrO(OH)2ģŃÉÕÖĘČ”ÄÉĆ×ZrO2Ź±£¬ÉżĪĀĖŁĀŹÓėÖŲĮæ°Ł·ÖĀŹÖ®¼äµÄ¹ŲĻµČēĶ¼£Ø2£©ĖłŹ¾”£
ģŃÉÕŹ±×ī¼ŃÉżĪĀĖŁĀŹĪŖ________________£¬ĄķÓÉŹĒ______________________”£
”¾“š°ø”æ ZrSiO4+4NaOH==Na2ZrO3+Na2SiO3+2H2O NaSiO3 Õ³ŗĻ¼Į£Ø»ņ·Ą»š¼ĮµČ£© Na2ZrO3+4H+==2Na++ZrO2++2H2O ZrO2+ÅضČŌ½“óZrO2Į£¾¶Ō½“ó µ±ZrO2+ĶźČ«³ĮµķŹ±£¬ÓÉKsp[ZrO(OH)2]=c(ZrO2+)”Įc2 (OH-)==1.0”Į10-5”Įc2(OH-)=4.0”Į10-26æÉÖŖc(OH-)==6.32”Į10-11”£Qc[Fe(OH)3]=(Fe3+)”Įc3(OH-)=0.03”Į(6.32”Į10-11)3=7.57”Į10-33>Ksp[Fe(OH)3]= 8.0”Į10-38£¬“ĖŹ±Fe3+ŅŃ¾³Įµķ”£Ņņ“Ė£¬ĪŽ·ØĶعżµ÷½ŚČÜŅŗpHÖĘµĆ“æ¾»µÄZrO(OH) 5”ę/min ŌŚŹ§ÖŲĻąĶ¬µÄĒéæöĻĀ£¬ÉżĪĀĖŁĀŹæģŹ±£¬·Ö½āĖłŠčĪĀ¶ČĻą¶Ō½ĻøߣØĘäĖūŗĻĄķ“š°ø¾łæÉ£¬ČēŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬ÉżĪĀĖŁĀŹøߏ±£¬Ź§ÖŲ°Ł·ÖĀŹŠ”£©
”¾½āĪö”æ£Ø1£©ZrSiO4ÓėNaOH¼ÓČČ·“Ӧɜ³ÉNa2ZrO3ŗĶNa2SiO3£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ZrSiO4+4NaOH= ZrSiO4+Na2SiO3+2H2O£¬ÕżČ·“š°ø£ŗZrSiO4+4NaOH==Na2ZrO3+Na2SiO3+2H2O”£
£Ø2£©·“Ó¦ŗó²śÉśµÄĖ®ČÜŠŌĪļÖŹĪŖNaOHŗĶNaSiO3£¬NaSiO3µÄÖ÷ŅŖÓĆĶ¾æÉŅŌ×ö½ØÖž²ÄĮĻµÄÕ³ŗĻ¼Į£Ø»ņ·Ą»š¼ĮµČ£©£»ÕżČ·“š°ø£ŗNaSiO3£»Õ³ŗĻ¼Į£Ø»ņ·Ą»š¼ĮµČ£©”£
£Ø3£©Na2ZrO3ŌŚĖįŠŌĢõ¼žĻĀ·Ö½āĪŖNa2ZrO£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖNa2ZrO3+4H+==2Na++ZrO2++2H2O£»ÕżČ·“š°ø£ŗNa2ZrO3+4H+==2Na++ZrO2++2H2O”£
£Ø4£©øł¾ŻĶ¼£Ø1£©·ÖĪöæÉÖŖ£¬ZrO2+ÅضČŌ½“óZrO2Į£¾¶Ō½“ó£¬ÕżČ·“š°ø£ŗZrO2+ÅضČŌ½“óZrO2Į£¾¶Ō½“ó”£
£Ø5£©µ±ZrO2+ĶźČ«³ĮµķŹ±£¬ÓÉKsp[ZrO(OH)2]=c(ZrO2+)”Įc2 (OH-)==1.0”Į10-5”Įc2(OH-)=4.0”Į10-26æÉÖŖc(OH-)==6.32”Į10-11”£Qc[Fe(OH)3]=(Fe3+)”Įc3(OH-)=0.03”Į(6.32”Į10-11)3=7.57”Į10-33>Ksp[Fe(OH)3]= 8.0”Į10-38£¬“ĖŹ±Fe3+ŅŃ¾³Įµķ”£Ņņ“Ė£¬ĪŽ·ØĶعżµ÷½ŚČÜŅŗpHÖĘµĆ“æ¾»µÄZrO(OH) £»ÕżČ·“š°ø£ŗ²»ÄÜÖĘµĆ“æ¾»µÄZrO(OH)”£
6£©ĶعżĶ¼£Ø2£©·ÖĪöæÉÖŖ£¬ČēŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬ÉżĪĀĖŁĀŹøߏ±£¬Ź§ÖŲ°Ł·ÖĀŹŠ”£¬Ņņ“ĖģŃÉÕŹ±×ī¼ŃÉżĪĀĖŁĀŹĪŖ5”ę/min£¬ÕżČ·“š°ø£ŗ5”ę/min£» ŌŚŹ§ÖŲĻąĶ¬µÄĒéæöĻĀ£¬ÉżĪĀĖŁĀŹæģŹ±£¬·Ö½āĖłŠčĪĀ¶ČĻą¶Ō½ĻøߣØĘäĖūŗĻĄķ“š°ø¾łæÉ£¬ČēŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬ÉżĪĀĖŁĀŹøߏ±£¬Ź§ÖŲ°Ł·ÖĀŹŠ”£©”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø Äæ±ź²āŹŌĻµĮŠ“š°ø
Äæ±ź²āŹŌĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠ¼Čŗ¬ÓŠĄė×Ó¼üÓÖŗ¬ÓŠ¹²¼Ū¼üµÄ»ÆŗĻĪļŹĒ£Ø £©
A.NaCl
B.H2O
C.KOH
D.CH3Cl
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀ£¬½«NO2ÓėSO2ŅŌĢå»ż±Č1”Ć2ÖĆÓŚŗćČŻĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗ
NO2(g)+SO2(B)![]() NO(g)+SO3(g)”÷H=-41.8kJ”¤mol-1,ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ£Ø £©
NO(g)+SO3(g)”÷H=-41.8kJ”¤mol-1,ÄÜĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ£Ø £©
A. ĢåĻµŃ¹Ēæ±£³Ö²»±ä B. »ģŗĻĘųĢåŃÕÉ«±£³Ö²»±ä
C. NOŗĶSO3µÄĪļÖŹµÄĮæÖ®±Č±£³Ö²»±ä D. ĆæĻūŗÄ1molNO2µÄĶ¬Ź±Éś³É1molSO3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖijŠ©¹²¼Ū¼üµÄ¼üÄÜČēĻĀ±ķĖłŹ¾£¬»š¼żČ¼ĮĻėĀ£ØN2H4£©µÄČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ŹĒ£ŗN2H4£Øg£©+O2£Øg£©=N2£Øg£©+2H2O£Øg£©”÷H=©5 akJmol©1ŌņO©HµÄ¼üÄÜĪŖ£Ø £©
¹²¼Ū½” | N©N | N©H | O=O | N”ŌN |
¼üÄÜkJmol©1 | 3a | 2.5a | 4a | 8a |
A.2a kJmol©1
B.2.5a kJmol©1
C.3a kJmol©1
D.3.5a kJmol©1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗN2(g) + 3H2(g)![]() 2NH3(g) ¦¤H = 92 kJ”¤mol-1£¬ĻĀĶ¼±ķŹ¾LŅ»¶ØŹ±£¬H2µÄĘ½ŗā×Ŗ»ÆĀŹ(¦Į)ĖęXµÄ±ä»Æ¹ŲĻµ£¬L(L1”¢L2)”¢XæÉ·Ö±š“ś±ķŃ¹Ēæ»ņĪĀ¶Č”£ĻĀĮŠĖµ·ØÖŠ£¬²»ÕżČ·µÄŹĒ
2NH3(g) ¦¤H = 92 kJ”¤mol-1£¬ĻĀĶ¼±ķŹ¾LŅ»¶ØŹ±£¬H2µÄĘ½ŗā×Ŗ»ÆĀŹ(¦Į)ĖęXµÄ±ä»Æ¹ŲĻµ£¬L(L1”¢L2)”¢XæÉ·Ö±š“ś±ķŃ¹Ēæ»ņĪĀ¶Č”£ĻĀĮŠĖµ·ØÖŠ£¬²»ÕżČ·µÄŹĒ

A£®X±ķŹ¾ĪĀ¶Č
B£®L2£¾L1
C£®·“Ó¦ĖŁĀŹ ¦Ō(M)£¾¦Ō(N)
D£®Ę½ŗā³£Źż K(M)£¾K(N)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅŠč0.5mol/LµÄNa2CO3ČÜŅŗ970mLŗĶ0.5mol/LĮņĖįČÜŅŗ250mL£®øł¾ŻÕāĮ½ÖÖČÜŅŗµÄÅäÖĘĒéæö»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ĻĀĮŠŅĒĘ÷Ź¹ÓĆĒ°±ŲŠė¼ģ²éŹĒ·ńĀ©Ė®µÄÓŠ_________(ĢīŠņŗÅ)”£
A£®ČŻĮæĘæ B£®ÕōĮóÉÕĘæ C£®·ÖŅŗĀ©¶· D£®ĮæĶ² E£®Õō·¢Ćó
(2)ŹµŃéŹŅŠč0.5mol/LµÄNa2CO3ČÜŅŗ970mL£¬ĻÖÓĆÓĆNa2CO3”¤10H2O¾§ĢåÅäÖĘ”£
¢ŁĖłŠčŅĒĘ÷³żĮĖÉÕ±”¢²£Į§°ō”¢ĮæĶ²”¢ĶŠÅĢĢģĘ½”¢Ņ©³×Ķā£¬»¹Č±ÉŁ_____________”¢_______________£»
øł¾Ż¼ĘĖćÓĆĶŠÅĢĢģĘ½³ĘČ”Na2CO3”¤10H2OµÄÖŹĮæŹĒ_______________ g”£
¢ŚĻĀĶ¼ŹĒijĶ¬Ń§ŌŚŹµŃéŹŅÅäÖĘøĆČÜŅŗµÄ¹ż³ĢĶ¼£¬ĘäÖŠÓŠ“ķĪóµÄŹĒ______________ (Ģī²Ł×÷ŠņŗÅ)”£

(3)Ä³Ń§ÉśÓūÓĆÖŹĮæ·ÖŹżĪŖ98%”¢ĆܶČĪŖ1.84g/cm3µÄÅØĮņĖįŗĶÕōĮóĖ®ÅäÖĘ0.5mol/LĮņĖįČÜŅŗ250mL”£
¢ŁøĆѧɜŠčŅŖÓĆĮæĶ²ĮæČ”________mLÉĻŹöÅØĮņĖį½ųŠŠÅäÖĘ”£
¢ŚÅäÖĘĮņĖįČÜŅŗŹ±£¬ĘäÕżČ·µÄ²Ł×÷Ė³ŠņŹĒB”śC ”ś ______”ś______”ś____”śD”£
A£®ÓĆ30 mLĖ®Ļ“µÓÉÕ±2”«3“Ī£¬Ļ“µÓŅŗ¾ł×¢ČėČŻĮæĘ棬ĒįĒįŅ”¶ÆČŻĮæĘæ
B£®ÓĆĮæĶ²×¼Č·ĮæČ”ĖłŠčÅØĮņĖįµÄĢå»ż£¬ĀżĀżŃŲ±±Ś×¢ČėŹ¢ÓŠŹŹĮæĖ®µÄÉÕ±ÖŠ£¬ÓĆ²£Į§°ōĀżĀż½Į¶Æ£¬Ź¹Ęä»ģŗĻ¾łŌČ
C£®½«ŅŃĄäČ“µÄĮņĖįŃŲ²£Į§°ō×¢ČėČŻĮæĘæÖŠ
D£®½«ČŻĮæĘæµÄ²£Į§ČūøĒ½ō£¬µßµ¹Ņ”ŌČ
E£®øÄÓĆ½ŗĶ·µĪ¹Ü¼ÓĖ®£¬Ź¹ČÜŅŗ°¼ĆęĒ”ŗĆÓėæĢ¶ČĻßĻąĒŠ
F£®¼ĢŠųĶłČŻĮæĘæÄŚŠ”ŠÄ¼ÓĖ®£¬Ö±µ½ŅŗĆę½Ó½üæĢ¶ČĻß1”«2 cm“¦
¢ŪŌŚÅäÖĘ¹ż³ĢÖŠ£¬ĻĀĮŠ²Ł×÷»įŹ¹ĖłÅäÖʵÄĻ”ĮņĖįĪļÖŹµÄĮæÅضČĘ«µĶŹĒ__________£ØĢī×ÖÄøŠņŗÅ£©”£
A£®¶ØČŻŹ±ŃöŹÓæĢ¶ČĻß B£®ČÜŅŗ×¢ČėČŻĮæĘæĒ°Ć»ÓŠ»Öø“µ½ŹŅĪĀ¾Ķ½ųŠŠ¶ØČŻ
C£®ČŻĮæĘæŹ¹ÓĆĒ°Ī“¾øÉŌļ D£®ÓĆĮæĶ²ĮæČ”ÅØĮņĖįŹ±ø©ŹÓ¹Ū²ģ°¼ŅŗĆę
E. Ī“½«ĮæČ”ÅØĮņĖįµÄĮæĶ²½ųŠŠĻ“µÓ
F£®¶ØČŻŗó¾Õńµ“”¢Ņ”ŌČ”¢¾²ÖĆ£¬·¢ĻÖŅŗĆęĻĀ½µ£¬ŌŁ¼ÓŹŹĮæµÄÕōĮóĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”浄¾§¹čŹĒŠÅĻ¢²śŅµÖŠÖŲŅŖµÄ»ł“”²ÄĮĻ£®Ķس£ÓĆĢ¼ŌŚøßĪĀĻĀ»¹Ō¶žŃõ»Æ¹čÖĘµĆ“Ö¹č(ŗ¬Ģś”¢ĀĮ£¬Åš£¬Į×µČŌÓÖŹ)£®“Ö¹čÓėĀČĘų·“Ӧɜ³ÉĖÄĀČ»Æ¹č(·“Ó¦ĪĀ¶Č450”Ŗ500 ”ę)£¬ĖÄĀČ»Æ¹č¾Ģį“æŗóÓĆĒāĘų»¹ŌæɵĆøß“æ¹č”£
ĀČĘųµÄÖĘČ”£ŗ

(1)ŹµŃéŹŅÓĆMnO2ŗĶÅØŃĪĖįÖĘČ”ĀČĘų£¬ČōŅŖÖʵĆøÉŌļ£¬“æ¾»µÄĀČĘų£¬ĖłŠč×°ÖĆµÄ½ÓæŚĮ¬½ÓĖ³ŠņŹĒ ___£ØĢīŠ”Š“×ÖÄø£©”£
(2)Š“³öŹµŃéŹŅÖĘČ”ĀČĘųµÄĄė×Ó·½³ĢŹ½£ŗ____ ”£
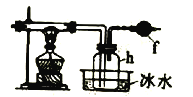
(3)×°ÖĆAÖŠŗćŃ¹·ÖŅŗĀ©¶·MÓė³£ÓĆ·ÖŅŗĀ©¶·Ļą±Č£¬ĘäÓŵćŹĒ _____£¬×°ÖĆDµÄ×÷ÓĆŹĒ____”£
½«ÉĻŹö·½·ØÖĘČ”µÄĀČĘųĶØČėĻĀĶ¼×°ÖĆÖŠæÉŅŌÖʵĆĖÄĀČ»Æ¹č”£
[׏ĮĻ]
a£®ĖÄĀČ»Æ¹čÓöĖ®¼«Ņ×Ė®½ā
b£®Åš”¢ĀĮ”¢Ģś£¬Į×ŌŚøßĪĀĻĀ¾łÄÜÓėĀČĘųÖ±½Ó·“Ӧɜ³ÉĻąÓ¦µÄĀČ»ÆĪļ
c.ÓŠ¹ŲĪļÖŹµÄČŪ·Šµć¼ūĻĀ±ķ£ŗ
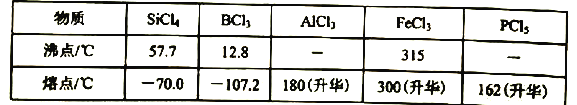
(4)×°ÖĆfÖŠŹ¢·ÅµÄŅ©Ę·ŹĒ____£¬hĘæÖŠ×ó±ßÓĆ“Öµ¼¹Üµ¼³öĪļÖŹµÄÄæµÄŹĒ____”£
(5)“ÓbĘæµĆµ½µÄŅŗĢåÖŠÕōĮó³öSiCl4£¬ĖłŠčÓƵ½µÄŅĒĘ÷ŹĒ ___”£
A£®ČŻĮæĘæ B£®ĪĀ¶Č¼Ę C£®ĄäÄż¹Ü D£®·ÖŅŗĀ©¶·
(6)ĪŖĮĖ·ÖĪö²ŠĮōĪļÖŠĢśŌŖĖŲµÄŗ¬Į棬ĻČ½«²ŠĮōĪļŌ¤“¦Ąķ£¬Ź¹ĢśŌŖĖŲ»¹Ō³ÉFe2£«£¬ŌŁÓĆKMnO4±ź×¼ČÜŅŗŌŚĖįŠŌĢõ¼žĻĀ½ųŠŠŃõ»Æ»¹ŌµĪ¶Ø£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ£ŗ5Fe2£«£«MnO4-£«8H£«=5Fe3£«£«Mn2£«£«4H2O ”£Ä³Ķ¬Ń§³ĘČ”5.000 g²ŠĮōĪļ£¬¾Ō¤“¦ĄķŗóŌŚČŻĮæĘæÖŠÅäÖĘ³É100 mLČÜŅŗ£¬ŅĘČ”25.00 mLŹŌŃłČÜŅŗ£¬ÓĆ1.000 ”Į 10£2 mol”¤L£1KMnO4±ź×¼ČÜŅŗµĪ¶Ø”£“ļµ½µĪ¶ØÖÕµćŹ±£¬Ļūŗıź×¼ČÜŅŗ20.00mL£¬µĪ¶ØÖÕµćµÄĻÖĻóŹĒ____£¬²ŠĮōĪļÖŠĢśŌŖĖŲµÄÖŹĮæ·ÖŹżŹĒ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻµēĄėĘ½ŗā³£Źż(ÓĆKa±ķŹ¾)µÄ“óŠ”æÉŅŌÅŠ¶Ļµē½āÖŹµÄĻą¶ŌĒæČõ”£25”ꏱ£¬ÓŠ¹ŲĪļÖŹµÄµēĄėĘ½ŗā³£ŹżČēĻĀ±ķĖłŹ¾£ŗ
»ÆѧŹ½ | HF | H2CO3 | HClO | H2SO3 |
µēĄėĘ½ŗā³£Źż(Ka) | Ka=7.2”Į10-4 | Ka1=4.2”Į10-7 Ka2=5.6”Į10-11 | Ka=3.0”Į10-8 | Ka1=1.0”Į10-2 Ka2=5.0”Į10-8 |
£Ø1£©25”ꏱ£¬Ķ¬ÅØ¶ČµÄHF”¢H2CO3”¢HClOČżÖÖČÜŅŗÖŠ£¬pH×ī“óµÄŹĒ____________(Š“»ÆѧŹ½)”£
£Ø2£©½«0.1mol”¤L-1µÄHFČÜŅŗ1mL¼ÓĖ®Ļ”ŹĶÖĮ10mL(¼ŁÉčĪĀ¶Č²»±ä)£¬ĻĀĮŠø÷ĮæŌö“óµÄŹĒ___________(ĢīŠ“×ÖÄø)”£
A£®c(H+) B£®c(H+)”¤c(OH-) C£®c(H+)/c(HF) D£®c(OH-)/c(H+)
£Ø3£©25”ꏱ£¬ĻÖÓŠĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1mol”¤L-1µÄĻĀĮŠĖÄÖÖČÜŅŗ£ŗ
¢ŁNa2CO3ČÜŅŗ ¢ŚNaHCO3ČÜŅŗ ¢ŪNaFČÜŅŗ ¢ÜNaClOČÜŅŗ”£
ŅĄ¾ŻŹż¾ŻÅŠ¶ĻĘäpHÓɓ󵽊”µÄĖ³ŠņŹĒ_________________________(ĢīŠ“ŠņŗÅ)”£
£Ø4£©øł¾ŻH2SO3µÄµēĄėĘ½ŗā³£Źż,¼ĘĖć25”ꏱ,0.05mol”¤L-1Na2SO3ČÜŅŗµÄpH=__________”£
ČōijNa2SO3ŗĶNaHSO3µÄ»ģŗĻŅŗ³ŹÖŠŠŌ£¬ŌņČÜŅŗÖŠc(SO32-)__________c(HSO3-)(Ģī”°“óÓŚ”±”¢”°Š”ÓŚ”°»ņ”°µČÓŚ")”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśĻĀĮŠ·“Ó¦£¬ĘäÖŠŹōÓŚŃĪĄąĖ®½ā·“Ó¦µÄŹĒ
A£®NH4++2H2O![]() NH3H2O+H3O+ B£®HCO3-+H2O
NH3H2O+H3O+ B£®HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C£®NH3+H2O![]() NH4++OH- D£®Cl2+H2O
NH4++OH- D£®Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com