
分析 化学式和离子符号表示电离过程的式子,称为电离方程式,电离方程式书写:1、先判断物质类型及电离出的阴阳离子;2、确定用可逆号还是等号;3、确定电离出的离子,离子团不能拆开;4、要注意原子守恒、电荷守恒;5、强电解质在溶液中能完全电离用“=”,弱电解质部分电离用“?”,多元弱酸,应分步电离,离子团在电离方程式中不能拆开,据此进行分析解答.
解答 解:(1)硫酸钠是强电解质,能完全电离,电离方程式为:Na2SO4=2Na++SO42-,
故答案为:Na2SO4=2Na++SO42-;
(2)碳酸铵是强电解质,电离时电离出自由移动的铵根离子和碳酸根离子,电离方程式为:(NH4)2CO3=2NH4++CO32-,
故答案为:(NH4)2CO3=2NH4++CO32-;
(3)一水合氨在溶液中电离出铵根离子和氢氧根离子,其电离方程式为:NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(4)醋酸是弱电解质,在水溶液里部分电离,电离方程式为:CH3COOH?H++CH3COO-,
故答案为:CH3COOH?H++CH3COO-.
点评 本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 .它位于元素周期表的第三周期,第ⅢA族.
.它位于元素周期表的第三周期,第ⅢA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
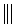 +
+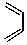 $\stackrel{△}{→}$
$\stackrel{△}{→}$ 如果要合成化合物A,其结构为:
如果要合成化合物A,其结构为: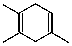 下列说法不正确的是( )
下列说法不正确的是( )| A. | 化合物A和HBr 按照物质的量1:1加成时,有三种不同的产物 | |
| B. | 该反应的原理是加成反应 | |
| C. | 合成A的原料可能是:丙炔和2,3-二甲基-1,3-丁二烯 | |
| D. | 合成A的原料可能是:2-丁炔和2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲根据实验现象证明酸性强弱:硝酸>碳酸>硅酸 | |
| B. | 图乙制备金属锰 | |
| C. | 图丙滴定管中溶液的液面读数为22.40mL | |
| D. | 图丁检验乙醇与浓硫酸加热至170℃产生的气体,必须有除杂装置X |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| D. | 除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在狗年里,人们相互祝愿亲朋好友:狗年旺旺,狗年大发.图是一种形状酷似一条小狗的有机物键线式结构图,化学家将其取名为“doggycene”,下列有关“doggycene”的说法中正确的是( )
在狗年里,人们相互祝愿亲朋好友:狗年旺旺,狗年大发.图是一种形状酷似一条小狗的有机物键线式结构图,化学家将其取名为“doggycene”,下列有关“doggycene”的说法中正确的是( )| A. | 该分子中所有碳原子不可能处于同一平面 | |
| B. | “doggycene”的分子式为C26H30 | |
| C. | 该物质在常温下呈气态 | |
| D. | 1 mol该物质在氧气中完全燃烧生成CO2和H2O的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com