
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ,
, ;
;
| ||
| ||
| ||
| ||


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
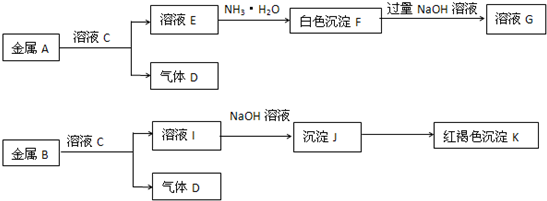
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | |||
| 4 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素.下列说法错误的是( )| A、原子半径:Z<W<Y<X |
| B、元素Y的氧化物能与NaOH溶液反应 |
| C、最简单气态氢化物的热稳定性:Y<X |
| D、W、Z的氧化物都能与碱反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两者都为s-s σ键 |
| B、两者都为p-p σ键 |
| C、前者为p-p σ键,后者为s-p σ键 |
| D、前者为s-s σ键,后者为s-p σ键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com