
| A. | 氢气在氯气中安静燃烧,发出苍白色火焰 | |
| B. | 铁丝在氯气中燃烧,产生棕褐色的烟 | |
| C. | 铜丝在氯气中燃烧,产生棕黄色的烟 | |
| D. | 钠在氯气中燃烧,产生黄色的烟 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| B. | 能使pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、CO32-、OH- | |
| D. | 能使淀粉KI试纸显蓝色的溶液:K+、SO42-、Fe2+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生在如图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题:
某学生在如图所示装置中用苯和液溴制取溴苯,请根据下列实验步骤完成有关问题: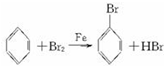 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com