
 ,
, ;
;| 1 |
| 4 |


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| A、对“地沟油”进行分馏可以获得汽油发动机的燃料 |
| B、乙烯和聚乙烯都可与溴水发生加成反应 |
| C、研究表明禽流感病毒H7N9在沸水中两分钟就能被杀死,是因为蛋白质受热易变性 |
| D、乙醇和乙酸的反应与苯和液溴的反应类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 对基苯甲醛,…俗称PHBA,是-种重要的有机化工原料.其结构如图所示
对基苯甲醛,…俗称PHBA,是-种重要的有机化工原料.其结构如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
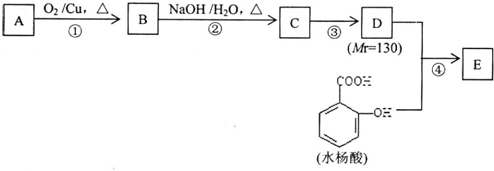

查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①②③④ |
| C、①③ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com