
| A、Ag+、Ca2+、Cl-、SO42- |
| B、Fe2+、H+、SO32-、ClO- |
| C、Mg2+、NH4+、Cl-、SO42- |
| D、K+、Fe3+、NO3-、SCN- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅在地壳中含量居第二位,在地球上有丰富的硅资源,如石英、水晶、玛瑙的主要成分都是单质硅 |
| B、在野外,用硅、烧碱的混合物可以制取氢气 |
| C、硅的性质稳定,不与任何酸反应 |
| D、硅是一种良好的半导体材料,所以是制造光导纤维的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| B、氯气溶于水:Cl2+H2O=2H++ClO-+Cl- |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
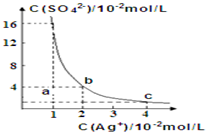 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是( )
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是( )| A、含有大量SO42-的溶液中肯定不存在Ag+ |
| B、Ag2SO4的溶度积常数(Ksp)为8×10-4 |
| C、a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| D、0.02mol?L-1的AgNO3溶液与0.2mol?L-1的Na2SO4溶液等体积混合不会生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| nA |
| tA |
| n(H2) |
| n(CH3OH) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com