
【题目】实验室用浓盐酸配制250mL0.1mol/L的盐酸溶液:
(1)配制250mL0.1mol/L盐酸溶液需要浓盐酸(密度为1.2g/mL,质量分数为36.5%)的体积为__。(保留小数点后一位)
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)配制物质的量浓度的溶液,造成浓度偏高的操作是___。(多选)
A.溶解后的溶液未冷至室温就转入容量瓶中;
B.洗涤烧杯和玻棒的溶液未转入容量瓶中;
C.定容时眼睛俯视刻度线;
D.定容时眼睛仰视刻度线;
【答案】2.1mL BCAFED AC
【解析】
(1)、根据![]() 计算浓盐酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓盐酸的体积;
计算浓盐酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓盐酸的体积;
(2)、根据配制溶液的实验操作过程进行操作顺序的排序;
(3)、分析操作对溶质的物质的量或对溶液的体积的影响,根据![]() 分析判断。
分析判断。
(1)、浓盐酸的物质的量浓度![]() ,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓盐酸的体积,设浓盐酸的体积为xmL,所以xmL×12.0mol/L=250mL×0.1mol/L,解得: x≈2.1,所需浓盐酸的体积为2.1mL,
,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓盐酸的体积,设浓盐酸的体积为xmL,所以xmL×12.0mol/L=250mL×0.1mol/L,解得: x≈2.1,所需浓盐酸的体积为2.1mL,
故答案为:2.1mL;
(2)、操作步骤有计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,用玻璃棒搅拌,恢复室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀。
所以操作顺序是BCAFED,
故答案为:BCAFED;
(3)A、溶液具有热胀冷缩的性质,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏高;
B、洗涤液中含有溶质氯化氢,移入容量瓶中溶质氯化氢的物质的量减小,所配溶液浓度偏低;
C、定容时俯视刻度线,导致溶液体积减小,所配溶液浓度偏高;
D、定容时仰视刻度线,导致溶液体积增大,所配溶液浓度偏低;
故选:AC;


科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是
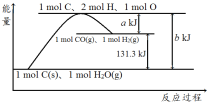
A. 反应的热化学方程式可表示为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量一定大于生成物成键放出的能量
C. 使用催化剂无法改变该反应的ΔH
D. nmol C和n mol H2O反应生成nmol CO和nmol H2吸收的热量一定为131.3nkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下反应方程式:
①SO3 + H2O=H2SO4; ②2Na2O2+2H2O=4NaOH+ O2↑;
③2Na+2H2O=2NaOH+ H2↑; ④SiO2+2NaOH=Na2SiO3+ H2O;
Ⅰ.按要求将上述化学方程式字母填入相应空格内:
上述反应中不属于氧化还原反应的有_________(填序号,下同);H2O做氧化剂的是_________。属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是______。
Ⅱ.已知方程式F:KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑。
(1)请用双线桥法标出电子转移的方向和数目___________________________________。
(2)标准状况下当有33.6 L的氯气放出时,转移电子的数目是__________。
(3)上述反应中氧化产物和还原产物的质量比为___________。
Ⅲ.酸性条件下,K2Cr2O7溶液和FeCl2溶液混合后生成Cr3+,请写出离子方程式 __________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜是人类最早使用的合金之一,主要由锌和铜组成。回答下列问题:
(1) 基态锌原子的核外价电子排布式为_______________,属于周期表__________区元素。电子占据最高能层的符号是_______________占据该能层电子的电子云轮廓图形状为______________
(2)第一电离能I1(Zn)________I1(Cu)(填“大于”或“小于”)
(3)向蓝色 ![]() 硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。
硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4] 2+。
①下列微粒中与SO42-互为等电子体的是__________(填序号)。
A.H2SO4 B.CO32- C.PO43- D.CCl4
②H2O分子中心原子的杂化类型为______;NH3分子的空间构型为________。
分子中的键角:H2O_______ NH3(填“大于”或“小于”)。
③通过上述实验现象可知:与Cu2+与的配位能力H2O_________NH3 (填“大于”或“小于”)。
④极具应用前景的氨硼烷(BH3·NH3)与乙烷互为等电子体。写出BH3·NH3的结构式(结构中若含配位键用“![]() ”表示)_______________________
”表示)_______________________
(4)金属Cu晶体中的原子堆积方式如图所示,这种堆积方式称为_____________。

(5)若Cu晶体的密度为ρg/cm3,![]() 表示阿伏加德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离________nm(不必化简)
表示阿伏加德罗常数的值,列式表示Cu晶体中最近的两个Cu原子之间的距离________nm(不必化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

按下列要求写出:
(1)聚乙烯的结构简式是_____________,乙醛的结构简式是_____________;
(2)反应①的化学方程式是________________________________,反应类型是___________;
(3)反应③的化学方程式是________________________________,反应类型是___________;
(4)反应⑤的化学方程式是________________________________,反应类型是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
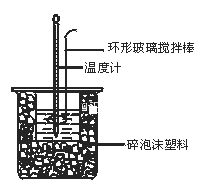
(1)图中环形搅拌棒能否用铜质用品代替______,原因是____________
(2)烧杯间填满碎纸条的作用是__________________________________
(3)每一次平行实验至少需要观察记录几次温度数值______
(4)大烧杯上如不盖硬纸板,求得的中和热数值_______________(填“偏大”“偏小”“无影响”)。
(5)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热____________(填“相等”“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0. 6 g H2中含有氢原子的物质的量为_________ mol。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为____________。
(3)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c(SO42-)=_____________。
(4)6.72L(标准状况)CO与一定量的Fe2O3恰好完全反应,生成Fe的质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C、D、E为单质,E为固体,F为有磁性的化合物。它们之间存在如下关系(反应中生成的水及次要产物均已略去):

(1)写出下列物质的化学式:B________,E________。
(2)指出MnO2在相关反应中的作用:反应①中是________剂,反应②中是________剂。
(3)若反应①是在加热条件下进行,则A是________(填化学式);若反应①是在常温条件下进行,则A是________(填化学式);如在上述两种条件下得到等质量的C单质,反应中转移的电子数之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列水溶液中的电离方程式或发生反应的离子方程式:
(1)小苏打溶于水___;
(2)用稀硫酸除掉镁条表面的氧化膜___;
(3)用胃舒平(有效成分是Al(OH) 3)治疗胃酸(主要成分是盐酸)过多___;
(4)用锌粉除去硫酸钾溶液中的Cd2+杂质(置换反应)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com