
ЁОЬтФПЁПЯТСаШШЛЏбЇЗНГЬЪНжаІЄHБэЪОПЩШМЮяШМЩеШШЕФЪЧ( )
A. CO(g)ЃЋ![]() O2(g)=CO2(g) ІЄHЃНЃ283 kJЁЄmolЃ1
O2(g)=CO2(g) ІЄHЃНЃ283 kJЁЄmolЃ1
B. CH4(g)ЃЋ2O2(g)=CO2(g)ЃЋ2H2O(g) ІЄHЃНЃ802.3 kJЁЄmolЃ1
C. 2H2(g)ЃЋO2(g)=2H2O(l) ІЄHЃНЃ571.6 kJЁЄmolЃ1
D. H2(g)ЃЋCl2(g)=2HCl(g) ІЄHЃНЃ184.6 kJЁЄmolЃ1
 ФмПМЪдЦкФЉГхДЬОэЯЕСаД№АИ
ФмПМЪдЦкФЉГхДЬОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаИїзщдЊЫижаЃЌАДзюИпе§МлЕндіЕФЫГађХХСаЕФЪЧ
A. NЁЂOЁЂF B. LiЁЂAlЁЂMg C. LiЁЂBЁЂC D. ClЁЂBrЁЂI
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнЯТСаСНИіШШЛЏбЇЗНГЬЪНЃЌЛиД№ЯТСаЮЪЬтЃК
2H2(g)+O2(g)![]() 2H2OЃЈ1ЃЉ ІЄH=571.6 kJ ЁЄ mol1
2H2OЃЈ1ЃЉ ІЄH=571.6 kJ ЁЄ mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ІЄH=2 220 kJ ЁЄ mol1
3CO2(g)+4H2O(l) ІЄH=2 220 kJ ЁЄ mol1
ЃЈ1ЃЉH2ЕФШМЩеШШЮЊ_______ЃЌC3H8ЕФШМЩеШШЮЊ_______ЁЃ
ЃЈ2ЃЉ1 mol H2КЭ2 mol C3H8зщГЩЕФЛьКЯЦјЬхЭъШЋШМЩеЪЭЗХЕФШШСПЮЊ______________ЁЃ
ЃЈ3ЃЉЯжгаH2КЭC3H8ЕФЛьКЯЦјЬхЙВ5 molЃЌЭъШЋШМЩеЪБЗХШШ3 847 kJЃЌдђдкЛьКЯЦјЬхжаH2КЭC3H8ЕФЬхЛ§БШЪЧ_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДзЫсКЭЧтбѕЛЏФЦШмвКЗЂЩњЗДгІЕФРызгЗНГЬЪНе§ШЗЕФЪЧ ЃЈ ЃЉ
A. H++OH-ЁњH2O
B. H++ NaOHЁњNa++H2O
C. CH3COOH +OH-ЁњCH3COO- +H2O
D. CH3COOH + NaOHЁњCH3COO-+ Na++H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЙЄвЕЩЯЃЌЯТСаН№ЪєЕФвБСЖЗНЗЈДэЮѓЕФЪЧ
A. МгШШЗЈвБСЖЙЏ B. ЕчНтЗЈвБСЖТС C. ЕчНтЗЈвБСЖЭ D. ШШЛЙдЗЈвБСЖЬњ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌНЋАБЫЎгыТШЛЏяЇШмвКЛьКЯЕУЕНc(NH3ЁЄH2O)+c(NH4+)=0.1 molЁЄL-1ЕФЛьКЯШмвКЁЃШмвКжаc(NH3ЁЄH2O)ЁЂc(NH4+)гыpHЕФЙиЯЕШчЭМЫљЪОЁЃЯТСагаЙиРызгХЈЖШЙиЯЕа№ЪівЛЖЈе§ШЗЕФЪЧ( ) 
AЃЎWЕуБэЪОШмвКжаЃКc(NH4+)+c(H+)=c(OH-)
BЃЎpH=10.5ШмвКжаЃКc(Cl-)+c(OH-)+c(NH3ЁЄH2O)<0.1 molЁЄL-1
CЃЎpH=9.5ШмвКжаЃКc(NH3ЁЄH2O)>c(NH4+)>c(OH-)>c(H+)
DЃЎЯђWЕуЫљБэЪОЕФ1 LШмвКжаМгШы0.05 mol NaOHЙЬЬх(КіТдШмвКЬхЛ§БфЛЏ)ЃКc(Cl-)>c(Na+)>c(OH-)>c(N H4+)>c(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгавдЯТЮяжЪЃКЂй NaOH ШмвК Ђк вКАБ ЂлBaCO3 ЙЬЬх Ђм ШлШкKHSO4Ђн Fe ( OH )3НКЬх Ђо Э Ђп CO2 Ђр CH3COOHЁЃ
ЃЈ1ЃЉвдЩЯЮяжЪжаЪєгкЛьКЯЮяЕФЪЧ_____ЃЈЬюађКХЃЉЁЃвдЩЯЮяжЪжаЪєгкЗЧЕчНтжЪЕФЪЧ_____ЃЈЬюађКХЃЉЁЃ
ЃЈ2ЃЉЖдЮяжЪЂнНјааЭЈЕчЃЌЙлВьЕНвѕбєСНМЋЕФЯжЯѓЪЧ_____ЁЃвдЩЯДПОЛЮяжаФмЕМЕчЕФЪЧ_____ЃЈЬюађКХЃЉЁЃ
ЃЈ3ЃЉаДГіЂйКЭЂрЕФЫЎШмвКЗДгІЕФРызгЗНГЬЪН________ЁЃ
ЃЈ4ЃЉаДГіЂмЕФЕчРыЗНГЬЪН_____ЁЃ
ЃЈ5ЃЉдкзуСПЂмЕФЫЎШмвКжаМгШыЩйСПЂлЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊ_____ЁЃ
ЃЈ6ЃЉдкКЌ0.4mol ЂйЕФШмвКжаЛКЛКЭЈШыБъзМзДПіЯТ6.72LCO2ЃЌЦјЬхБЛШЋВПЮќЪеЃЌдђЗДгІКѓШмвКЕФШмжЪга_____ЃЈЬюЛЏбЇЪНЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКЂйCO(g) +H2O(g)=CO2(g)+H2(g) ІЄH =Ѓ41.2 kJЁЄ mol-1
ЂкCH4(g) +H2O(g)=CO(g) +3H2(g)ЕФФмСПБфЛЏШчЭМЫљЪОЃК ЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
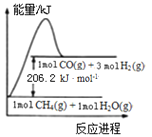
A. ЂйКЭЂкОљЮЊЗХШШЗДгІ
B. ЂйЕФЗДгІЮязмФмСПЕЭгкЩњГЩЮязмФмСП
C. CO2(g) +CH4(g)=2CO(g) +2H2(g) ІЄH =Ѓ247.4 kJЁЄ mol-1
D. CH4(g) +H2O(g)=CO(g) +3H2(g)ЕФЛюЛЏФмДѓгк206.2 kJ ЁЄ mol-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. Н№ЪєюбадФмЗЧГЃгХдНЃЌЙуЗКгІгУгквНСЦМАШеГЃгУЦЗжаЁЃ
B. ЭбЮШмвКЖМгаЖОЁЃ
C. ЯЁЭСН№ЪєБЛГЦЮЊвБН№ЙЄвЕЕФЮЌЩњЫиЃЌ80%ЗжВМдкФЯЗЧЕШЗЧжоЙњМвЁЃ
D. гЩгкН№ЪєТСГЃЮТЯТВЛгыбѕЦјЗДгІЃЌЫљвдБЃДцТСЪБВЛашвЊИєОјПеЦјЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com