
【题目】运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)请配平以下化学方程式:
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为___________L。
(2)25℃时,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为_____________。
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
HSO3-的电离平衡常数表达式K=_________。
0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
【答案】(1) 10、6、4、10、3、2;11.2;(2) a;
(3) Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(4)①![]() ;② c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
;② c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③ H2SO3+HCO3-=HSO3-+CO2↑+H2O。
【解析】
试题分析:(1)Al的价态由0价→+3价↑3,N由+5价→0价↓5,最小公倍数是15,即Al、NaAlO2的系数为5,NaNO3的系数为3,N2的系数为3/2,根据Na元素守恒,NaOH的系数为2,H2O的系数为1,因此反应方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O;(2)当盐酸和氨水恰好完全反应,生成NH4Cl,氯化铵属于强酸弱碱盐,NH4+水解,即有c(Cl-)>c(NH4+),如果出现c(NH4+)>c(Cl-),只能是盐酸不足,氨水过量,故选项a正确;(3)因为Ba(OH)2是少量,因此Ba(OH)2的系数为1,离子反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;(4)①HSO3-![]() H++SO32-,电离平衡常数为K=
H++SO32-,电离平衡常数为K=![]() ;②SO32-+H2O
;②SO32-+H2O![]() HSO3-+OH-,水解程度非常微弱,同时溶液中水要发生电离,即离子浓度大小顺序是c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);③根据电离平衡常数,H2SO3的第一级电离大于碳酸的第一级电离,碳酸的第一级电离大于HSO3-电离,HSO3-的电离大于HCO3-的电离,因此发生离子反应是:H2SO3+HCO3-=HSO3-+CO2↑+H2O。
HSO3-+OH-,水解程度非常微弱,同时溶液中水要发生电离,即离子浓度大小顺序是c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);③根据电离平衡常数,H2SO3的第一级电离大于碳酸的第一级电离,碳酸的第一级电离大于HSO3-电离,HSO3-的电离大于HCO3-的电离,因此发生离子反应是:H2SO3+HCO3-=HSO3-+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烷与氯气在光照条件下发生加成反应
B.将石蜡油(液态烷烃混合物)加强热分解生成的气体都是烷烃
C.甲苯能够使溴的四氯化碳溶液和酸性的高锰酸钾溶液褪色
D.乙醇能够被酸性的高锰酸钾溶液直接氧化成乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成图①所示的“蜗牛”形状,图中每个“.”代表一种元素,其中P点代表氢元素。
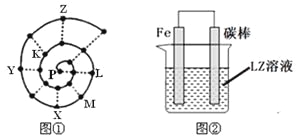
(1)X元素在常规周期表中的位置 (填周期和族)。
(2)写出M与Z两种元素形成的化合物的电子式 。
(3)下列说法正确的是_______
a.Z元素对应的氢化物比K元素对应的氢化物沸点高
b.虚线相连的元素处于同一主族
c.K、L、X三种元素的离子半径大小顺序是X3+>L +>K 2
d.由K、L两种元素组成的化合物中可能含有共价键
(4)图②装置可以模拟钢铁的腐蚀,铁棒一极的电极反应式是 。若在图②溶液中滴加少量酚酞溶液并进行电解,发现Fe电极附近溶液变红,写出该电解池的离子方程式 _。牺牲阳极的阴极保护法利用的是 _原理(填“电解池”或“原电池”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI![]() H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是____________。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。

0~2 min内的平均反应速率v(HI)=____________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=____________。
2HI(g)的平衡常数K=____________。
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的____________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代科技高度发达,下列有关古代文献的说法,错误的是( )
A.明朝的《本草纲目》记载“烧酒非古法也,自元时创始,其法用浓酒和糟入甑(指蒸锅),蒸令气上,用器承滴露。”该段文字记载了白酒(烧酒)的制造过程中采用了蒸馏的方法来分离和提纯
B.汉朝的《淮南万毕术》、《神农本草经》记载“白青(碱式碳酸铜)得铁化为铜”,“石胆……能化铁为铜”都是指铜可以采用湿法冶炼
C.清初《泉州府志》物产条载: “初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之。”该段文字记载了蔗糖的分离提纯采用了黄泥来吸附红糖中的色素
D.晋代葛洪的《抱朴子》记载“丹砂烧之成水银,积变又成丹砂”,是指加热时丹砂(HgS)熔融成液态,冷却时重新结晶为HgS晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】
硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态铁原子的外围电子排布式为___________;Fe3+比Fe2+稳定的原因是___________。
(2)第二周期中,元素的第一电离能处于B与N之间的元素有___________种。
(3)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为___________;在NF3中,N原子的杂化轨道类型为___________。
(4)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___________,层间作用力为___________。
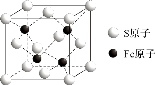
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为___________。假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)___________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:① NH3、② Na2SiO3、③ Al、④ NaHCO3。其中,能与稀盐酸反应得到胶体的是______(填序号,下同);与NaOH溶液和稀硫酸均反应生成氢气的是______;可以受热分解生成CO2的是______;能使湿润的红色石蕊试纸变蓝的气体是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com