
【题目】下列有关氨气(NH3)的描述错误的是( )
A.有刺激性气味B.可用于工业制硝酸
C.难溶于水D.可用于工业制氮肥
科目:高中化学 来源: 题型:
【题目】(1)硫酸在下列用途或反应中各表现的性质是(用字母填在横线上)
A.难挥发性 B.酸性 C.吸水性 D.脱水性 E.强氧化性 F.催化作用
①敞口放置浓硫酸时,质量增加 _______,
②浓硫酸使润湿蓝色石蕊试纸先变红后又变黑___________,
③浓硫酸与铜反应_____________;
(2)氮氧化物也是造成酸雨的成分之一,治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转换装置,使NO和CO反应,生成无毒气体,反应的化学方程式是_________________________________________;
(3)喷泉是一种常见的自然现象,其产生的原因是存在压强差;提供如图的装置,请说明引发喷泉的方法____________________________________;
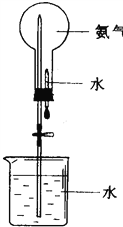
(4)为了测定某铜银合金的成分,将17.2 g合金溶于40 mL 12.25 mol/L的浓硝酸中,待合金完全溶解后,收集到3.36 L(标准状况下)气体(气体为NO和NO2混合气体),并测得溶液中c(H+)=1mol/L,假设反应后溶液的体积仍为40 mL,则合金中铜的质量分数为_______________( 保留两位有效数字),收集到的混合气体中NO与NO2的体积之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:
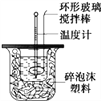
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)实验数据如下表:
①请填写下表中的空白:________。
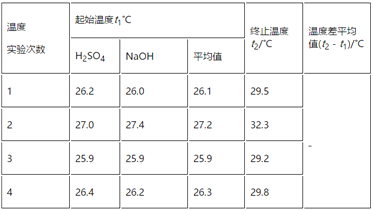
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是(______)。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量硫酸溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列目的能达到的是( )
A.将58.5 g NaCl溶于1 L水中,可得1 mol/L的NaCl溶液
B.可使用250 mL容量瓶分两次完成490 mL某浓度的BaCl2溶液的配制
C.将25.0 g胆矾溶于水后配成100 mL溶液所得溶液浓度为1 mol/L
D.将78 g Na2O2溶于水配成1 L溶液,可得到浓度为1 mol/L的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:①![]() C和
C和![]() C;②石墨和足球烯C60;③漂白粉和漂白液的主要成分;④正丁烷和异庚烷;⑤乙烯和聚乙烯;⑥
C;②石墨和足球烯C60;③漂白粉和漂白液的主要成分;④正丁烷和异庚烷;⑤乙烯和聚乙烯;⑥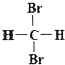 和
和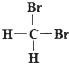 ;⑦丙烷和环丙烷;⑧CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3。请用序号填空:
;⑦丙烷和环丙烷;⑧CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3。请用序号填空:
(1)__________组两者互为同位素。
(2)__________组两者互为同素异形体。
(3)__________组两者属于同系物。
(4)__________组两者互为同分异构体。
(5)__________组两者是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu放入盛有稀HNO3的容器中发生如下反应:3Cu+8HNO3(稀)=3Cu(NO3)2 + 2x↑+4H2O,则x为无色的____(填化学式)气体,遇空气后迅速变为____色的NO2,该反应中氧化剂是____,还原剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学力程式为______________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为____________________________。
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·2H2O+HC2O4-的平衡常数K=___。(已知常温下,NH3·H2O的电离平衡常数Kb≈2×10-5,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5)
NH3·2H2O+HC2O4-的平衡常数K=___。(已知常温下,NH3·H2O的电离平衡常数Kb≈2×10-5,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5)
(5)如图是在酸性电解质溶液中,以情性材料作电极,将CO2转化为丙烯的原理模型。
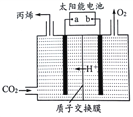
①太阳能电池的负极是_________。(填“a”或“b”)
②生成丙烯的电极反应式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由2﹣氯丙烷制得少量的HOCH2CH(OH)CH3 需要经过下列几步反应( )
A.消去→加成→水解
B.加成→消去→取代
C.取代→消去→加成
D.消去→加成→消去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线画出. 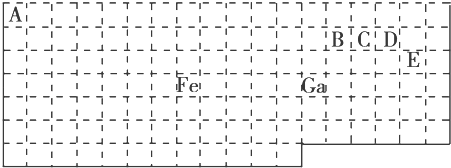
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的区;Fe和CO易形成配合物Fe(CO)5 , 在Fe(CO)5中铁的化合价为 .
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征.与CO互为等电子体的分子和离子分别为和(填化学式).
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 .
(5)根据VSEPR模型预测ED4﹣的空间构型为 . B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子为(写2种).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com