
| A. | 纤维素 涤纶 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 淀粉 聚异戊二烯 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止试管破裂,加热固体碳酸氢钠时,试管口应略向下倾斜 | |
| B. | 为防止液体暴沸,蒸馏时可在烧瓶中加入少量碎瓷片 | |
| C. | 容量瓶可用于配制一定物质的量浓度的溶液,不可作为反应容器使用 | |
| D. | 配制500mL 0.1 mol/L NaOH溶液时,将2g NaOH固体倒入500mL容量瓶中,加水至凹液面与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +NaOH→
+NaOH→ +CH3OH.
+CH3OH. ,化合物Ⅳ通过消去反应生成化合物I的化学方程式为
,化合物Ⅳ通过消去反应生成化合物I的化学方程式为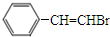 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O(注明反应条件).
+NaBr+H2O(注明反应条件).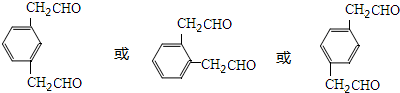
 单体的结构简式为
单体的结构简式为
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com